При описании любого элемента принято указывать его первооткрывателя и обстоятельства открытия. Такими данными об элементе № 47 человечество не располагает. Ни один из прославленных ученых к открытию серебра не причастен. Серебром люди стали пользоваться еще тогда, когда не было ученых.
О происхождении русского слова «серебро» ученые и доныне не пришли к единому мнению. Большинство из них считают, что это видоизмененное «сарпу», которое в языке древних ассирийцев означало как серп, так и полумесяц. В Ассирии считалось «металлом Луны» и было таким же священным, как в Египте .
С развитием товарных отношений , как и , стало выразителем стоимости. Пожалуй, можно сказать, что в этой своей роли оно способствовало развитию торговли даже больше, чем «царь металлов». Оно было дешевле золота, соотношение стоимости этих металлов в большинстве древних государств было 1: 10. Крупную торговлю удобнее было вести через посредство золота, мелкая же, более массовая, требовала серебра.
Пайка серебром
С инженерной точки зрения серебро, подобно золоту, долгое время считалось бесполезным металлом, практически не влиявшим на развитие техники, точнее, почти бесполезным. Еще в древности его применяли для пайки. Температура плавления серебра не столь уже высока - 960,5° С, ниже, чем золота (1063° С) и меди (1083,2°С). Сравнивать с другими металлами не имеет смысла: ассортимент металлов древности был очень невелик. (Даже намного позже, в средневековье, алхимики считали, что «семь металлов создал свет по числу семи планет».)
Однако если мы раскроем современный справочник по материаловедению, и там найдем несколько серебряных припоев: ПСр-10, ПСр-12, ПСр-25; цифра указывает на процентное содержание серебра (остальное и 1% цинка) . В технике эти припои занимают особое место, ибо паянный ими шов не только прочен и плотен, но и коррозионно устойчив. Никто, конечно не подумает запаивать такими припоями кастрюли, ведра или консервные банки, но судовые трубопроводы, котлы высокого давления, трансформаторы, электрические шины в них очень нуждаются. В частности, сплав ПСр-12 используют для пайки патрубков, штуцеров, коллекторов и другой аппаратуры из меди, а также из медных сплавов с содержанием основного металла больше 58 %.
Чем выше требования к прочности и коррозионной устойчивости паяного шва, тем с большим процентом серебра применяются припои. В отдельных случаях используют припои с 70% серебра. А для пайки титана годно лишь чистое серебро.
Мягкий свинцово-серебряный припой нередко применяют в качестве заменителя олова. На первый взгляд это кажется нелепостью: «металл консервной банки», как окрестил академик А. Е. Ферсман, заменяется валютным металлом - серебром! Однако удивляться здесь нечему, это вопрос стоимости. Самый ходовой оловянный припой ПОС-40 включает в себя 40% олова ж около 60% свинца. Заменяющий же его серебряный припой содержит всего лишь 2,5% драгоценного металла, а всю остальную массу составляет .
Значение серебряных припоев в технике неуклонно растет. Об этом можно судить по недавно опубликованным данным. В них указывалось, что только в США на эти цели расходуется до 840 т серебра в год.
Зеркальное отражение серебра
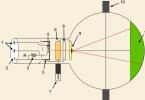
Другое, почти столь же древнее техническое использование серебра - производство зеркал. До того как научились получать листовое и стеклянные зеркала, люди пользовались отполированными до блеска металлическими пластинками. Золотые зеркала были слишком дороги, но не столько это обстоятельство препятствовало их распространению, сколько желтоватый оттенок, который они придавали отражению. Бронзовые зеркала были сравнительно дешевы, но страдали тем же недостатком и к тому же быстро тускнели. Отполированные же серебряные пластины отражали все черточки лица без наложения какого-либо оттенка и в же время достаточно хорошо сохранялись.
Первые стеклянные зеркала, появившиеся еще в I в. н. э., были «бессеребренниками»: стеклянная пластинка соединялась со свинцовой или оловянной. Такие зеркала исчезли в средние века, их вновь потеснили металлические. В XVII в. была разработана новая технология изготовления зеркал; их отражающая поверхность была сделана из амальгамы олова. Однако позже серебро вернулось в эту отрасль производства, вытеснив из нее и , и . Французский химик Птижан и немецкий - Либих разработали рецепты серебрильных растворов, которые (с небольшими изменениями) сохранились до нашего времени. Химическая схема серебрения зеркал общеизвестна: восстановление металлического серебра из аммиачного раствора его солей с помощью глюкозы или формалина.
В миллионах автомобильных и прочих фар свет электрической лампочки усиливается вогнутым зеркалом. Зеркала есть во множестве оптических приборов. Зеркалами снабжены маяки.
Зеркала прожекторов в годы войны помогали обнаружить врага в воздухе, на море и на суше; иногда с помощью прожекторов решались тактические и стратегические задачи. Так, при штурме Берлина войсками Первого Белорусского фронта 143 прожектора огромной светосилы ослепили гитлеровцев в их оборонительной полосе, и это способствовало быстрому исходу операции.
Серебряное зеркало проникает в космос и, к сожалению, не только в приборах. 7 мая 1968 г. в Совет Безопасности был направлен протест правительства Камбоджи против американского проекта запуска на орбиту спутника-зеркала. Это спутник - нечто вроде огромного надувного матраца со сверхлегким металлическим покрытием. На орбите «матрац» наполняется газом и превращается в гигантское космическое зеркало, которое, по замыслу его создателей, должно было отражать на Землю солнечный свет и освещать площадь в 100 тыс. км2 с силой, равной свету двух лун. Назначение проекта - осветить обширные территории Вьетнама в интересах войск США и их сателлитов.
Почему так энергично запротестовала Камбоджа? Дело в том, что при осуществлении проекта мог нарушиться световой режим растений, а это в свою очередь вызвать неурожай и голод в государствах Индокитайского полуострова. Протест возымел действие: «матрац» в космос не полетел.
И пластичность, и блеск. «Светлое тело, которое ковать можно»,- так определял М. В. . «Типичный» металл должен обладать высокой пластичностью, металлическим блеском, звонкостью, высокой теплопроводностью и электропроводностью. Применительно к этим требованиям серебро, можно сказать, из металлов металл.
Судите сами: из серебра можно получить листки толщиной всего лишь 0,25 мкм.
Металлический блеск - отражательная способность, о которой говорилось выше. Можно добавить, что в последнее время получили распространение родиевые зеркала, более стойкие к воздействию влаги и различных газов. Но по отражательной способности они уступают серебряным (75-80 и 95-97% соответственно). Поэтому сочли более рациональным покрытие зеркал делать все же серебря-ным, а поверх него наносить тончайшую пленку родия, предохраняющую серебро от потускнения.
В технике весьма распространено серебрение. Тончайшую серебряную пленку наносят не только (и не столько) ради а высокой отражательной способности покрытия, а прежде всего ради химической стойкости и повышенной электропроводности. Кроме того, этому покрытию свойственны эластичность и прекрасное сцепление с основным металлом.
Здесь опять возможна реплика придирчивого читателя: о какой химической стойкости может идти речь, когда в предыдущем абзаце говорилось о защите серебряного покрытия родиевой пленкой? Противоречия, как это ни странно, нет. Химическая стойкость - понятие многогранное. Серебро лучше многих других металлов противостоит действию щелочей. Именно поэтому стенки трубопроводов, автоклавов, реакторов и других аппаратов химической промышленности нередко покрывают серебром как защитным металлом. В электрических аккумуляторах с щелочным электролитом многие детали подвергаются опасности воздействия на них едкого кали или натра высокой концентрации. В же время детали эти должны обладать высокой электропроводностью. Лучшего материала для них, чем серебро, обладающее устойчивостью к щелочам и замечательной электропроводностью, не найти. Из всех металлов серебро самый электропроводный. Но высокая стоимость элемента № 47 во многих случаях заставляет пользоваться не серебряными, а посеребренными деталями. Серебряные покрытия хороши еще и тем, что они прочны и плотны - беспористы.
По электропроводности при нормальной температуре серебру нет равных. Серебряные проводники незаменимы в приборах высокой точности, когда недопустим риск. Ведь не случайно в годы второй мировой войны казначейство США раскошелилось, выдав военному ведомству около 40 т драгоценного серебра. К не на что-нибудь, а на замену меди! Серебро потребовалось авторам «Манхэттен-ского проекта». (Позже стало известно, что это был шифр работ по созданию атомной бомбы.)
Следует отметить, что серебро - лучший электропроводник при нормальных условиях, но, в отличие от многих металлов и сплавов, оно не становится сверхпроводником в условиях предельно достижимого холода. Так же, кстати, ведет себя и . Как ни парадоксально, но именно эти, замечательные по электропроводности при сверхнизких температурах используют в качестве электроизоляторов.
Машиностроители шутя утверждают, что земной шар крутится на подшипниках. Если бы так было на самом деле, то можно не сомневаться-в столь ответственном узле наверняка применялись бы многослойные подшипники, в которых один или несколько слоев серебряные. Танки и самолеты были первыми потребителями драгоценных подшипников.
В США, например, производство подшипников из серебра началось в 1942 г., тогда на их производство было выделено 311 т драгоценного металла. Через год эта цифра выросла до 778 т.
Выше мы упоминали о таком качестве металлов, как звонкость. И по звонкости серебро заметно выделяется среди других металлов. Недаром во многих сказках фигурируют серебряные колокольчики. Колокольных дел мастера издавна добавляли серебро в бронзу «для малинового звона». В наше время струны некоторых музыкальных инструментов делают из сплава, в котором 90% серебра.
Серебро в фото и кино
Фотография и кинематограф появились в XIX в. и дали серебру еще одну работу. Особое качество элемента № 47 - светочувствительность его солей.
Более 100 лет известен фотопроцесс, но в чем его сущность, каков механизм реакции, лежащей в его основе? До последнего времени это представляли весьма приближенно.
На первый взгляд все просто: свет возбуждает химическую реакцию, и металлическое серебро выделяется из серебряной соли, в частности из бромистого серебра -лучшего из светочувствительных материалов. В желатине, нанесенной на , пленку или бумагу, эта соль содержится в виде кристаллов с ионной решеткой. Можно предположить, что квант света, падая на такой кристалл, усиливает колебания электрона на орбите иона брома и дает ему возможность перейти к иону серебра. Таким образом, пойдут реакции
Вr ⁻ + hν → Br + e ⁻
Ag ⁺ + е ⁻ → Ag.
Однако весьма существенно то, что состояние AgBr более устойчиво, чем состояние Ag+Br. Выяснилось, что чистое лишено светочувствительности.
В чём же тогда дело? Как оказалось, чувствительны к действию света только дефектные кристаллы AgHr. В их Кристаллической решетке есть своего рода пустоты, которые заполнены добавочными атомами серебра или брома. Эти атомы более подвижны и играют роль «электронных ловушек», затрудняя обратный переход электрона к брому. После того как электрон будет «выбит из седла» квантом света, один из «посторонних» атомов обязательно примет его. Вокруг такого «зародыша светочувствительности» адсорбируются и закрепляются выделившиеся из решетки атомы серебра. Освещенная пластинка ничем не отличается от неосвещенной. Изображение на ней появляется лишь после проявления. Этот процесс усиливает действие «зародышей светочувствительности», и изображение после закрепления становится видимым. Такова принципиальная схема, дающая самое общее представление о механизме фотопроцесса.
Фото- и кинопромышленность стали крупнейшими потребителями серебра. В 1931 г., например, США на эти цели расходовали 146 т драгоценного металла, а в 1958- уже 933 т.
Старые фотоснимки и, в частности, фотодокументы со временем выцветают. До последнего времени был лишь один способ их восстановления - репродукция, пересъемка (с неизбежными потерями качества). Совсем недавно найден иной способ реставрации старых фотографий.
Снимок облучают нейтронами, и серебро, которым он «нарисован», превращается в свой короткоживущий радиоактивный изотоп. В течение нескольких минут это серебро испускает гамма-лучи, и если в это время на фотографию наложить пластинку или пленку с мелкозернистой эмульсией, то можно получить изображение, более четкое, чем на оригинале.
Светочувствительность серебряных солей используют не только в фотографии и кино. Недавно из Германии и США почти одновременно поступили сообщения об универсальных защитных очках. Стекла их изготовлены из прозрачных эфиров целлюлозы, в которых растворено небольшое количество галогенидов серебра. При нормальном освещении такие очки пропускают около половины падающих на них световых лучей. Если же свет становится сильнее, то пропускная способность стекол падает до 5-10%, поскольку происходит восстановление части серебра и , естественно, становится менее прозрачным. А когда свет снова слабеет, происходит обратная реакция и стекла приобретают большую прозрачность.
Серебро - металл (фото смотрите ниже), который является одним из редких химических элементов. Чаще всего он используется для изготовления ювелирных украшений.
Однако серебро - металл, у которого обширная сфера применения. Без него не обходится кинематография и медицина, фотография и инженерная область. Применяют серебро и в качестве средства инвестирования. В этом плане оно ничуть не уступает золоту. Наоборот, серебро нередко используется инвесторами для диверсификации рисков.
Серебро как химический элемент
Серебро - металл или неметалл? Разумеется, металл. И подтвердить это может периодическая система, составленная Менделеевым. Найти этот металл можно в ее первой группе. Атомный номер серебра - 47. Его атомная масса равна 107,8682.

Серебро - благородный металл, который состоит из двух изотопов. Это 107Ag и 109Ag. Кроме того, наукой открыты более тридцати пяти радиоактивных изомеров и изотопов серебра, массовые числа которых составляют от 99 до 123. Наиболее долгоживущий из них - 109Ag - имеет период полураспада, равный 130 годам.
История происхождения названия
Серебро - металл, который привлек внимание людей еще в древние времена. Название «серебро» происходит от санскритского слова «аргента». Означает оно «светлый». Латинское «аргентум» (серебро) имеет такие же корни. Но на этом языке оно означает «белое».
Серебро - благородный металл, и его не обошли стороной алхимики. В далекие времена они разработали метод купирования этого природного элемента.

На русском языке рассматриваемый металл носит название «серебро», на английском это звучит как «сильвер», на немецком - «зильбер». Все эти слова произошли от древнеиндийского «сарпа», означавшего Луну. Объяснение этому вполне простое. Блеск серебра напоминал людям свет таинственного небесного тела.
История благородного металла
Серебро знакомо человечеству с незапамятных времен. Точная дата его открытия неизвестна. Однако письменные источники указывают на то, что украшения из этого металла изготавливались еще древними египтянами. В тот период серебро встречалось реже, чем золото, и поэтому ценилось значительно выше.
Первые рудники по добыче этого были основаны финикийцами еще до нашей эры. Разработки велись на Кипре и на Корсике, а также в Испании.
В качестве ювелирных украшений в тот период серебро ценилось баснословно дорого. К примеру, в Древнем Риме вершиной роскоши была солонка из этого красивого металла. Почему же такой распространенный в природе элемент настолько ценился людьми? Дело в том, что человечество знало только самородный металл. Найти его было очень сложно. Этому мешал сульфид, который покрывает темным налетом все самородки.
Поворотной вехой в истории серебра стали эксперименты, проводимые средневековыми алхимиками. Целью их опытов было получение золота из любого другого металла. Таким образом, европейцам удалось извлечь серебро из его соединений с различными химическими элементами (мышьяком, хлором и т.д.).
В истории серебра значительную роль сыграли такие личности, как Шееле, Парацельс и др. Данными учеными исследовалось серебро (металл), свойства его соединений. В результате были сделаны интересные выводы. Так, подтвердился тот факт, что данный природный элемент обладает дезинфицирующими качествами, которые были замечены еще в далекой древности. Например, знахари Египта применяли серебряные пластины для обработки ран, чтобы избежать образования в них гноя. Высокие антибактериальные свойства этого металла оценила и аристократия. Так, долгие века синонимом качественной и дорогой посуды являлось столовое серебро. К тому времени человечество усовершенствовало способы добычи описываемого металла, что позволило его значительно удешевить.
Серебро использовалось и в качестве расчетного средства. Для этого из него изготавливались монеты. Именно серебру россияне обязаны названием государственной денежной единицы. Для расчетов на Руси отрубалось нужное количество от Вот так слово «рубль» и вошло в обиход.
Физические свойства
Серебро - металл сравнительно пластичный и мягкий. Из одного его грамма может быть вытянута тончайшая проволочка, длина которой составит почти два километра.
Серебро - тяжелый металл, имеющий плотность 10,5 грамма на кубический сантиметр. По этому показателю данный элемент лишь немного уступает свинцу.
Серебро - металл, которому нет равных по электро- и теплопроводности. Именно поэтому так быстро нагревается в стакане горячей воды ложка, изготовленная из этого вещества.
Какими еще свойствами обладает серебро? Какой металл чаще всего используют ювелиры? Серебро - материал, с которым работать относительно легко. Это обусловливается его способностью плавиться при температуре в 962 градуса. Данное значение является относительно низким. Кроме того, серебро легко сплавлять со многими другими металлами для изменения его характеристик. Так, медь способна увеличить твердость этого пластичного природного элемента. При ее добавлении серебро становится годным для изготовления разнообразных изделий.
Этот удивительный элемент подробно описывал в своих трудах Д.И. Менделеев. Он же и указывал, как определить металл серебро среди других. Прежде всего, благородный компонент выделяется своим более белым и чистым цветом. Кроме того, серебро настолько мягкое, что легко подвергается стиранию.
Химические свойства
Как отличить серебро от металла в уже готовых изделиях? Кольца, цепочки, ложки, вилки, подстаканники и старинные монеты со временем начинают тускнеть и даже чернеют. Причиной тому становится воздействие на них сероводорода. Источником последнего являются не только тухлые яйца. Сероводород выделяет резина и некоторые полимеры. Химическая реакция происходит при наличии некоторого количества влаги. На поверхности изделий при этом образуется тончайшая пленка сульфида. Вначале благодаря игре света она кажется радужной. Однако постепенно сульфидная пленка утолщается. Она темнеет, меняет свой цвет на коричневый, а затем и на черный.
Сульфид серебра невозможно разрушить при сильном нагреве, растворить в щелочах и кислотах. Если пленка не очень толстая, то она удаляется механическим путем. Изделие достаточно отполировать порошком или зубной пастой с мыльной водой, чтобы вернуть его блеск.

Как отличить серебро от металла другими способами? Для этого следует понаблюдать за химическими реакциями. Благородный элемент можно легко растворить в некоторых кислотах. Это азотная и концентрированная горячая серная, а также йодо- и Если химическая реакция между серебром и соляной кислотой проходила в присутствии кислорода, то ее результатом окажутся комплексные галогениды благородного металла.
Серебро не будет взаимодействовать с азотом и водородом. Оно не вступает в реакцию и с углеродом. Что касается фосфора, то он может воздействовать на серебро, только достигнув температуры красного каления, при которой образуются фосфиды. А вот с серой благородный металл взаимодействует довольно легко. При нагревании этих элементов образуется сульфид. Такое же вещество можно получить в случае воздействия газообразной серы на нагретый металл.
Интерес представляет химическая реакция благородного металла с кислородом. С ним серебро не реагирует, но растворить значительное количество данного газа все же может. Такое свойство металла при его нагревании способствует появлению очень опасного, но в то же время красивого явления. Это разбрызгивание серебра. Данное явление было известно еще в древние времена.
Серебро - металл, свойства которого позволяют ему, подобно золоту, легко взаимодействовать с а также с соляной кислотой, насыщенной хлором. В результате такой реакции оно выпадает в нерастворимый осадок, так как образуется малорастворимый хлорид. Эти различия в поведении серебра и золота нередко используют для их разделения.
Способен лунный металл раствориться и в разбавленной серной кислоте. Однако для этого серебро должно быть тонкодисперсным и контактировать с кислородом.
Благородный металл можно растворить в водных растворах щелочноземельных и щелочных металлов, цианидов, если они достаточно насыщены воздухом. Такая же реакция наступает и при контакте серебра с водным раствором тиомочевины, в котором имеются соли железа.
Соединения лунного металла, как правило, имеют положительную первую степень окисления. В некоторых элементах этот показатель достигает значения в два или три. Однако такие соединения серебра не имеют практического значения.
Биологические свойства
Серебро - металл (фото смотрите ниже), которого в живых веществах содержится в шесть раз меньше, чем в почвах. Другими словами, этот элемент не относят к биологическим.

Однако небольшого количества положительных ионов серебра вполне достаточно для протекания многих процессов. Например, с древних времен известна способность низких концентраций этого металла оказывать бактерицидное воздействие на питьевую воду. Даже такое небольшое количество ионов, как 0,05 миллиграмма на литр, обеспечивает достаточную антимикробную активность. Такую воду можно употреблять без опасения за свое здоровье. Интересно, что ее вкус при этом остается неизменным.
Если в литре жидкости имеется 0,1 миллиграмма ионов серебра, то ее можно законсервировать на один год. Но не стоит при этом подвергать воду кипячению. Высокая температура приводит к тому, что ионы серебра становятся неактивными.
Бактерицидное свойство благородного элемента позволяет широко использовать его с целью стерилизации питьевой воды. Так, в некоторых бытовых фильтрах находится активированный посеребренный уголь. Этот компонент выделяет в воду ничтожно малые дозы целебных ионов.
Антимикробная способность серебра находит свое применение и при дезинфекции бассейнов. В них воду насыщают бромидом этого металла. Низкая концентрация AgBr (0,08 мг/л) безвредна для человека и губительна для водорослей и патогенных микроорганизмов.
Чем можно объяснить бактерицидное действие ионов серебра? Дело в том, что они влияют на жизнедеятельность различных микробов, мешая работе их Именно так и действует серебро. Какой металл еще способен на такое? К подобным веществам относится, например, ртуть. Она, как и серебро, - тяжелый металл, однако намного токсичнее. легко растворяются в воде, они опасны для здоровья человека. Аналогичными свойствами обладает и медь.
Отрицательное влияние серебра
Нередко случается так, что вещество, которое полезно для человека в малых дозах, становится губительным в больших количествах. К таким элементам можно отнести и серебро. Экспериментальным путем доказано, что значительные объемы ионов этого металла способны снизить иммунитет у подопытных животных, внести негативные изменения в нервные и сосудистые ткани головного мозга. Еще большие дозы повреждают печень, щитовидную железу и почки. На практике зафиксированы случаи, когда человек получал отравление от препаратов серебра, которое сопровождалось тяжелыми психическими нарушениями. К счастью, этот элемент без труда выводится организмом.
Патологическое состояние, вызываемое лунным металлом
В медицинской практике встречается необычное заболевание, которое называют аргирией. Оно появляется у человека в том случае, если в течение многих лет своей жизни он работает с серебром или его солями. Эти вещества небольшими дозами поступают в организм, отлагаясь в соединительных тканях, а также в стенках капилляров почек, костного мозга и селезенки. О внешних симптомах этой патологии убедительно говорят расположенные ниже картинки.
Серебро - металл, который постепенно накапливается в слизистых и в кожных покровах, придавая им голубоватую или серо-зеленую окраску. При этом она становится особенно яркой на тех участках тела, которые подвержены воздействию света. Иногда цвет кожи настолько изменяется, что человек становится похожим на африканца.

Развитие аргирии происходит очень медленно. Первые ее симптомы становятся заметны спустя два-четыре года постоянной работы с серебром. Наиболее сильное потемнение наблюдается через десятки лет. Прежде всего изменяется цвет губ, висков, конъюнктивы глаз. Затем темнеют веки. Иногда окрашиваются десны и слизистые ротовой полости, а также ногтевые лунки. Иногда аргирия проявляется в виде мелких зелено-синих пятен.
Избавиться от данной патологии и вернуть коже прежнюю окраску невозможно. Однако, помимо внешних косметических неудобств, больной не жалуется ни на что. Именно поэтому аргирию можно лишь условно считать заболеванием. У данной патологии есть своя положительная сторона. Человек, буквально пропитанный серебром, никогда не страдает от инфекционных недугов. Целебные ионы убивают все попадающие в организм болезнетворные микроорганизмы.
Схожие металлы
Серебро - цветной металл, который иногда сложно отличить от схожих с ним по внешнему виду. Сделать это непросто, но вполне реально.
Металл, похожий на серебро, может быть белым золотом, мельхиором или алюминием. Как же различить их? Определить, выполнено изделие из серебра или из белого золота, могут лишь профессионалы, знакомые со спецификой данных металлов. Делать это самому в домашних условиях не рекомендуется.
Внешне эти два металла очень схожи между собой. Дело в том, что в сплаве белого золота находится большой процент серебра. Различить изделия из этих материалов способен только ювелир, который вычислит оригинал по плотности.
Серебро - цветной металл, который часто путают с мельхиором. Последний представляет собой сплав из никеля, свинца и меди. Нередко мельхиор - это производственное составляющее серебра различных технических проб. Как же отличить «металл под серебро»? Прежде всего, необходимо внимательно рассмотреть имеющееся изделие. На мельхиоровом не будет стоять проба. На таких изделиях ставят только клеймо «МНЦ», которое свидетельствует о составе сплава (медь, никель и свинец). Серебро отличается от сплава плотностью и весом. Однако данные характеристики способен установить только специалист. Дома можно капнуть на изделие раствором йода. На серебре после этого останется пятно, а на мельхиоре - нет.
Часто за благородный металл пытаются выдать алюминий. Однако последний имеет существенные отличия от серебра по плотности, блеску, твердости и цвету. Изделия-подделки пытаются реализовать только в подворотнях и различных лавках. Такое украшение после непродолжительной носки начинает окисляться. Отличить серебро от алюминия можно при помощи магнита. Благородный металл к нему не притянется. Кроме того, любое физическое или химическое воздействие на алюминий вызывает изменение его цвета, внешнего вида и деформацию размеров.
Серебро и ювелирная мода
Благодаря доступности из этого материала выполняется большое количество различных украшений. Серебро - драгоценный металл или нет? Да, оно находится в одной группе с золотом и платиной. Это благородные металлы, которые не подвергаются окислению и коррозии. Драгоценными их называют не только из-за уникальных свойств, но и из-за небольших запасов, содержащихся в земной коре.
Серебро - материал универсальный. Оно одинаково хорошо подходит и женщинам, и мужчинам, имеющим различный социальный статус и возраст. Серебро великолепно сочетается с эмалью, с золотом. На нем замечательно смотрятся драгоценные и полудрагоценные камни, жемчуг, кораллы и слоновая кость.
Украшения из серебра подойдут для любого случая. Причем из большого разнообразия моделей можно всегда подобрать изделие для определенного повода. Помимо этого, согласно древним представлениям об этом металле, он способен исцелять и успокаивать. Именно поэтому не стоит в наш безумно скоростной век отказывать себе в приобретении небольшой радости.
На сегодняшний день ювелиры предлагают огромное количество самых различных украшений, материалом для изготовления которых послужило серебро. Каждое из этих изделий непременно подарит хорошее настроение. Узнать их на витрине ювелирного магазина несложно.
Серебро - самый светлый благородный металл. Неудивительно, что спрос на украшения из него устойчив во всех странах мира. Важным фактором популярности изделий из серебра является их цвет. Ведь одной из самых модных считается одежда из серой с металлическим отливом ткани, а также из черной и белой. Эта тенденция перешла на украшения из драгоценных металлов. Высок покупательский спрос на изделия, в которых серебро сочетается с сапфиром, изумрудом, топазом, гранатом, аметистом, турмалином. Нередко в качестве вставок применяют малахит и лазурит, агат и яшму, сердолик и халцедон, янтарь и Часто серебро используют при создании колец и кулонов с финифтью, филигранью, гравировкой и эмалью.

У всех этих украшений имеется замечательная альтернатива. Для создания ювелирных изделий применяется металл, покрытый серебром. На вид и по своему качеству такие вещи ничем не отличаются от тех, которые полностью выполнены из благородного материала. Одним из положительных моментов является их цена. Она приятно удивляет покупателей. Кроме того, посеребренные украшения подойдут тем, кто имеет чувствительную кожу. Такие изделия не вызывают никаких раздражений и не оставляют следов при ношении. Об их качестве говорит тот факт, что они с течением времени не ржавеют и не темнеют. Таким образом, посеребренные кольца, цепочки, браслеты и кулоны будут отличным подарком любимому человеку или другу. Их стоимость вполне приемлемая, да и качество отличное.
Серебро было известно человечеству еще 6 тысяч лет назад. Серебро - химический элемент 11 группы Таблицы Менделеева, обозначается Ag (от лат. Argrntum), благородный металл серебристо-белого цвета. Цвет серебра и дал ему название, латинское слово Argentum происходит от греческого argos - блестящий.
Серебро в природе
Серебро является достаточно редким элементом, в литосфере его содержится всего около 0,000001%. Это примерно в тысячу раз меньше, чем содержание меди в земной коре. Несмотря на редкость, серебро чаще встречается в виде самородков, поэтому то оно и было известно с незапамятных времен. Сейчас самородное серебро стало редкостью, основная часть серебра находится в разнообразных минералах, основным из которых является аргентит Ag 2 S. Также большая часть находится в так называемых полиметаллических рудах, в них серебро соседствует с такими металлами как свинец , цинк и медь.
Исторические факты о серебре
Существует легенда, что первые серебряные рудники были открыты в 968 г. никем иным как основателем Священной Римской империи восточно-франкским королём Оттоном I Великим. Легенда гласит, что однажды король послал своего егеря в лес на охоту. Во время охоты тот привязал коня к дереву, который в ожидании хозяина разрыл копытами землю, где оказались необычные светлые камни. Император понял, что это серебро и повелел основать на этом месте рудник. Существуют данные, что этот богатейший рудник разрабатывался еще спустя шесть веков. Об этом свидетельствуют записи немецкого врача и металлурга Георга Агриколы (1494–1555).
Вообще Центральная Европа была очень богата залежами серебряных самородков. В Саксонии в 1477 году был найден один из самых больших самородков в истории массой до 20 тонн! Из серебра добытого в Чехии, близ города Иоахимсталя, были отчеканены миллионы европейских монет. Поэтому их так и называли - «иоахимсталер»; со временем слово укоротилось до «талера». В России это название переиначили на свой лад и у нас они назывались «ефи́мками». Серебряные талеры были самой распространенной европейской монетой в истории, от этого название пошло современное название «доллар».
Чешский богемский Иоахимсталер
Европейские серебряные рудники были настолько богаты, что расход серебра измерялся в тоннах! Но т.к. основная масса европейских серебряных рудников была открыта в XIV-XVI вв., то к настоящему времени они уже истощены.
После открытия Америки оказалось, что этот континент очень богат на серебро. Его залежи были обнаружены в Чили, Перу и Мексике. Аргентина даже получила название по латинскому имени серебра. Тут нужно указать на очень интересный факт. Географические названия химических элементов обычно давались элементу от названия какого-то места, например, гафний назван так от латинского наименования города Копенгаген, в котором он был открыт, географические названия имеют элементы полоний, рутений, галлий и другие. Тут же произошло все с точностью наоборот. Страна была названа по имени химического элемента! Это единственный подобный случай в истории. Самородки серебра находят в Америке и в настоящее время. Один из них был открыт уже в XX веке в Канаде. Этот самородок был длиной 30 метров и глубиной 18 метров! После освоения этого самородка оказалось, что он содержал 20 тонн чистого серебра!
Химические свойства серебра
Серебро - сравнительно мягкий и пластичный металл, из 1 г его можно вытянуть металлическую нить длиной 2 км! Серебро тяжёлый металл, имеет низкую теплопроводность и электропроводность. Температура плавления относительно невысок, всего 962° С. Серебро охотно образует сплавы с другими металлами, которые придают ему новые свойства, например, при добавлении меди получается более твердый сплав - биллон.
При нормальных условиях серебро не подвержено окислению, однако имеет способность поглощать кислород . Твердое серебро при нагреве способно растворить в пять раз больший объем кислорода! В жидком серебре растворяются еще больший объем газа, примерно 20:1.
Иод способен воздействовать на серебро. Особенно благородный металл «боится» иодную настойку и сероводород. В этом и заключается причина потемнения серебра со временем. Источником сероводорода в быту служат испорченные яйца, резина, некоторые полимеры. При реакции сероводорода и серебра, особенно при повышенной влажности, на поверхности металла образуется очень прочная сульфидная плёнка, которая не разрушается при нагреве и воздействии кислот и щелочей. Удалить её можно только механическим способом, например щеткой с нанесенной на неё зубной пастой.
Интересны биохимические свойства серебра. Несмотря на то, что серебро не является биоэлементом оно способно оказывать влияние на жизнедеятельность микробов подавляя работу их ферментов. Это происходит при соединении серебра с аминокислотой, входящей в состав фермента. Поэтому вода в серебряных сосудах не портится, т.к. в ней подавляется жизнедеятельность бактерий.
Применение серебра
Уже с давних времен серебро использовали при изготовлении зеркал, в настоящее время его заменяют алюминием для удешевления производства. Низкое электрическое сопротивление серебра находит применение в электротехнике и электронике, тут из него изготавливают разнообразные контакты и разъемы. В настоящее время серебро практически не используют для производства монет, из него изготавливают только памятные монеты. Большая часть серебра используется в ювелирном деле, при изготовлении столовых приборов. Серебро также широко используется в химической и пищевой промышленности.
Интересно применение иодида серебра. С его помощью можно управлять погодой. Распыляя ничтожные количества иодида серебра с самолета, добиваются образования водяных капель, т.е. проще говоря вызывается дождь. При необходимости можно выполнить и противоположную задачу, когда дождь совершенно не нужен, например, при проведении какого-то очень важного мероприятия. Для этого иодид серебра распыляют за десятки километров до места события, тогда дождь прольется там, а в нужном месте будет сухая погода.
Серебро широко применяется в медицине. Его используют как зубные протезы, в производстве лекарств (колларгол, протаргол, ляпис и др.) и медицинских инструментов.

Влияние серебра на человека
Как мы видели выше, использование небольших доз серебра имеет обеззараживающее и бактерицидное действие. Однако, что полезно в малых дозах, очень часто бывает губительно в больших. Серебро здесь не исключение. Повышение концентрации серебра в организме может вызвать снижение иммунитета, повреждения почек и печени, щитовидной железы и головного мозга. В медицине описаны случаи нарушения психики при отравлении серебром.
Многолетнее поступление серебра в организм малыми дозами приводит к развитию аргирии. Металл постепенно откладывается в тканях органов и придает им зеленоватый или голубоватый цвет, особенно виден этот эффект на коже. При тяжелых случаях аргирии кожа темнеет настолько, что становится похожа на кожу африканцев. Кроме косметического эффекта в остальном аргирия не оказывает какого то ухудшения самочувствия и расстройства работы организма. Но и тут имеется свой плюс, при том, что организм пропитан серебром, ему становятся нипочем любые инфекционные заболевания!
 Американец Пол Карсон «Папа Смурф», страдавший аргирией
Американец Пол Карсон «Папа Смурф», страдавший аргирией
Серебро химический элемент
(Argentum, argent, Silber), хим. знак Ag. - С. принадлежит к числу металлов, известных человеку еще в глубокой древности. В природе оно встречается как в самородном состоянии, так и в виде соединений с другими телами (с серой, напр. Ag 2
S - серебряный блеск, с хлором, напр. AgCl - роговое серебро, с селеном - Ag2
Se, с мышьяком, сурьмой, медью, ртутью, золотом, свинцом и пр.). С. встречается в морской воде (в 100 л около 0,001 г) и в золе некоторых растений; указывают на присутствие его в солнечной атмосфере. Физические свойства. Химические свойства. Соединения Галоидные соединения
С серой
С. дает полусернистое
и сернистое
С
. Ag4
S и Ag 2
S. Полусернистое С. получается при действии сероводорода на Ag 4
F2
в виде черного аморфного вещества. Слабая азотная кислота растворяет его при нагревании; также растворяет его крепкая серная кислота (без выделения серы) и концентрированный раствор KCN. При стоянии Ag 4
S водой разлагается на металлич. С. и Ag 2
S. Сернистое С. Ag 2
S получается при накаливании С. в парах серы или в струе Н 2
S, при сдавливании (до 7000 ат.) смеси металлич. С. с серой, при действии H 2
S или сернистых щелочей на растворы серебряных солей и пр. Обыкновенно получающееся Ag 2
S аморфно, кристаллизуется же оно в формах правильной и гексагональной системы. Водород разлагает его при нагревании; при обжигании на воздухе Ag 2
S дает Ag и сернистый газ. Азотная кислота растворяет Ag 2
S, при этом выделяется сера (отличие Ag 2
S от Ag 4
S); KCN тоже растворяет его; в аммиаке и сернистом аммонии оно не растворяется. Сернистое С. образует многочисленный двойные соединения с сернистым свинцом, мышьяком, медью, сурьмой, калием и пр. С углеродом
С. образует Ag 4
C (получается при накаливании С. с сажей), Ag 2
C, Ag2
C2
. Известны также соединения С. с мышьяком, сурьмой, кремнием и пр.
(кислородных кислот). Наибольшее значение имеет азотнокислое
С
. AgNO3
, которое было известно еще алхимикам под разными названиями (Crystalli Dianae, Magisterium argenti, Lapis infernalis в новейшей медицине и т. д.). Наиболее просто получается AgNO 3
растворением металлического С. в разбавленной азотной кислоте при нагревании (при этом выделяются окислы азота). Для растворения С. нельзя брать крепкой азотной кислоты, потому что AgNO 3
в ней плохо растворяется и, покрывая С. как бы коркой, затрудняет доступ к нему кислоты. В дополнение к сказанному о свойствах AgNO 3
в ст. Ляпис (см.) добавим следующее. Насыщенный водный раствор его кипит при 125°. Водный спирт растворяет AgNO 3
тем сильнее, чем больше спирт содержит воды. При 15° 100 ч. 95% спирта растворяют 3,8; 80% - 10,3; 70% - 22,1, 60% - 30,5; 50% - 35,8; 40% - 56,4; 30% - 73,7; 20% - 107; 10% - 158. При повышении темп. растворимость в спирте увеличивается; при 50°, напр., она возрастает почти вдвое. Эфир растворяет ничтожное количество AgNO 3
. Хлор и йод в водном растворе дают при действии на AgNO 3
хлорноватые или йодноватые соли, напр.: 6AgNO 3
+ ЗСl 2
+ ЗН 2
O = 5AgCl + AgClO3
+ 6HNO3
. Азотнокислое С. поглощает в сухом состоянии газообразный аммиак и дает соединение AgNO 3
3H3
N. При действии аммиака на водный раствор AgNO 3
в первый момент происходит осадок, который растворяется в избытке аммиака; при сгущении раствора получаются большие ромбические кристаллы AgNO 3
3NH3
. Азотнокислое С. образует много двойных солей, напр., с азотнокислыми солями аммония, калия, натрия, лития, свинца и пр. Азотистокислое С.
AgNO2
получается при нагревании AgNO 3
или двойным разложением растворимых солей С. с азотистокислыми щелочными металлами, напр.: AgNO 3
+ KNO2
= AgNO2
+ KNO3
или Ag 2
SO4
+ Ва(NO 2
)2
= 2AgNO2
+ BaSO4
и пр. AgNO 2
- кристаллическое вещество, легко разлагающееся при нагревании (особенно во влажном состоянии), растворяется в воде гораздо хуже, чем AgNO 3
, легко растворяется в аммиаке, дает двойные соли с азотистокислыми солями др. металлов и пр. Сернокислое
С
. Ag2
SO4
получается или растворением С. в серной кислоте при нагревании, или разложением серебряных солей, напр. AgNO 3
, при выпаривании с серной кислотой. Ag 2
SO4
- кристаллическое вещество, мало растворимое в воде (100 ч. воды при 18° растворяют 0,58 ч. Ag 2
SO4
), довольно прочное (разлагается при очень высокой темп.). Углекислое С
. Ag2
CO3
образуется проще всего при двойном разложении AgNO 3
с поташом или содой. Оно не растворимо в воде; при нагревании выше 100° происходит отчасти выделение СО 2
. Фосфорнокислое
С
. Ag3
PO4
получается при двойном разложении фосфорнокислого натра Na 2
PO4
или Na 3
PO4
с растворимыми солями С. Фосфорнокислое С. представляет кристаллич. вещество желтого цвета, нерастворимое в воде; растворяется в азотной, уксусной, фосфорной и др. кислотах, в аммиаке и пр. Хромовокислое
С
. Ag2
CrO4
получается при двойных разложениях серебряных солей с хромово-калиевой солью K 2
CrО 4
; темно-красное вещество, нерастворимое в воде; растворимо в аммиаке и азотной кислоте; если при разложении брать двухромовокалиевую соль вместо K 2
CrO4
, то получается двухромовокислое С., которое несколько более растворимо в воде. Хлорноватокислое
С. AgClO 3
получается при пропускании хлора в воду, в которой взболтана окись С. При этом образуется сначала хлористое С. и хлорноватистая кислота НСlО, дающая с Ag 2
O хлорноватистокислое С. AgClO, напр.: Ag 2
O + Cl2
+ H2
O = AgCl + AgClO + H2
O; хлорноватистокислое С. разлагается в свою очередь на AgCl и AgClO 3
по уравн. 3AgClO = 2AgCl + AgClO 3
. Хлорноватокислое С. на свету постоянно, недурно растворяется в воде, при нагревании (выше 270°) разлагается, выделяя кислород; сернистая кислота в водном растворе восстановляет его до AgCl, окисляясь сама в серную кислоту и пр. Бромноватокислое
AgBrO3
и йодноватокислое
С
. AgJО 3
получается при действии брома или йода на окись С. или при обменном разложении азотно-серебряной соли с бромноватокислым или йодноватокислым калием. AgBrO 3
и AgJO 3
в воде очень мало растворимы, на свету не изменяются, действуют окислительно на органические вещества и пр. Серебряные соли органических кислот в большинстве случаев при накаливании разлагаются, выделяя металлическое С.; многие соли при этом взрывают, напр., щавелево-серебряная Ag 2
C2
O4
.
С. образует многочисленные сплавы
с другими металлами. Присутствие меди делает более звонким, более твердым; сплавы С. с медью более прочны, менее стираются, и потому в таком виде С. и идет для чеканки монет, для производства украшений и пр. С увеличением содержания меди цвет сплавов более и более приближается к красному, темп. плавл. понижается (до некоторого предела, затем она снова увеличивается). Со свинцом С. сплавляется легко и во всех пропорциях, чем пользуются для извлечения С. (см. С. металлургия). При застывании подобных сплавов выделяются определенные соединения С. со свинцом. С золотом С. тоже сплавляется во всех пропорциях (см. Золото). Так же легко получаются сплавы с платиной, никелем, цинком, оловом, ртутью, кадмием и другими металлами.
Определение атомного веса С. было предметом замечательных по своей точности работ Стаса. Прежде всего Стас определял синтезом, какое количество хлора, брома и йода соединяется с 100 ч. С. для образования хлористого, бромистого и йодистого С.; с другой стороны, произведя разложение хлорновато- AgClO 3
, бромновато- AgBrO 3
и йодновато- AgJO 3
серебряных солей, он нашел отношение между весом кислорода, заключающегося в них, и хлористым, бромистым и йодистым С., получающимися при разложении (напр.: AgClO 3
= AgCl + O3
). Предполагая, что в частице этих солей находится на 1 атом С. 1 атом галоида и 3 атома кислорода и принимая атомный вес кислорода 16, можно было вычислить атомный вес С., а вместе с тем и атомные веса хлора, брома и йода. Чтобы исключить погрешности метода, Стас должен был производить как анализы, так и синтезы различными способами. Напр., для определения состава хлористого серебра он определенную навеску С. растворял в азотной кислоте и разлагал полученное азотнокислое С. соляной кислотой, хлористым натрием, нашатырем и пр. Также и хлорновато-серебряная соль разлагалась то нагреванием, то действием сернистой кислоты и пр. Эти исследования со всеми принятыми предосторожностями потребовали долгие годы усиленной работы. Атомный вес С., зная состав AgCl, AgBr, AgJ, найден из анализа AgClO 3
- 107,937; AgBrО 3
- 107,921; AgJO3
- 107,928. Кроме того, Стас определил отношение между весом серы и С. в сернистом С. Ag 2
S и затем отношение между весом кислорода и сернистым С. в сернокислом С. Ag 2
SO4
, откуда был вычислен атомный вес С. Беря среднее из всех отдельных определений, Стас нашел атомный вес С. равным 107,93. Еще раньше Стаса Мариньяк определил его равным 107,928. При всех своих исследованиях Стас исходил из определенной навески С., в чистоте которого он убедился многими опытами. В конце 70-х годов Дюма (учитель Стаса) выразил сомнение в этом: именно, приготовляя чистое С., Стас должен был плавить его на воздухе, и Дюма указал, что при этом оно растворяет газы, которые отчасти остаются в нем и при застывании и выделяются при нагревании в пустоте даже раньше плавления С. По опытам Дюма, количество их в 1000 г до 0,25 г. Стас ввиду этого вновь приступил к продолжительной работе, результаты который выяснились только после его смерти. Перечисляя опыты Стаса, Кларк нашел для атомного веса С. 107,675 (при H = 1) и 107,023 (при О - 16). Для получения химически чистого С. Стас применял несколько способов. Продажное С., содержащее главным образом медь (серебряная монета), растворялось в слабой азотной кислоте, жидкость выпаривалась досуха, полученные соли сплавлялись для разложения азотнокислой соли платины, которая иногда встречается в С. (напр., во франц. монете). Сплавленная масса растворялась в небольшом количестве воды и фильтровалась; по разбавлении водой AgCl осаждалось чистой соляной кислотой и промывалось сначала горячей водой, подкисленной НСl, затем чистой водой. По высушивании AgCl растиралось в порошок, нагревалось продолжительное время с царской водкой и вновь промывалось водой. Для восстановления оно нагревалось при 70° - 80° с молочным сахаром в растворе чистого поташа. Осажденное С. промывалось водой, кипятилось со слабой серной кислотой, высушивалось, смешивалось с 5% сухой и чистой буры, содержавшей 10% селитры, и сплавлялось. С. отливалось в формы, выложенные каолином; слитки С. очищались от каолина сначала механическим путем, затем накаливанием в поташе и промывкой водой. Разрезав С. на мелкие порции стальными ножницами, его нагревали со слабой соляной кислотой для удаления следов железа, попавшего из ножниц, промывали аммиаком, водой и, нагрев до высокой температуры, помещали в склянку с притертой пробкой. В другом случае, растворив монету в азотной кислоте и сплавив полученные соли, Стас растворял массу в слабом аммиаке и прибавлял к раствору после фильтрования чистый сернистокислый аммоний (NH 4
)SO3
. При стоянии и при некотором нагревании происходило восстановление С. Выделившееся С. промывалось аммиаком и чистой водой и сплавлялось. Для получения чистого С. его выделяли иногда в виде AgCl и сплавляли с углекислым калием, натрием или растворяли в цианистом калии и осаждали током, напр., на посеребренной фарфоровой пластинке. Полученное С. Стас иногда подвергал перегонке. Для этой цели он делал два небольших углубления в куске извести, полученной из чистого мрамора; углубления соединялись желобком, и в одно из них помещалось С. Этот кусок извести покрывался другим куском, который имел два отверстия, лежащие как раз над углублениями. В одно из них вставлялась горелка для гремучего газа с платиновым наконечником, другое отверстие служило для выхода газов. Пары С. конденсировались в находившемся здесь углублении. Аллотропическое Анализ серебряных соединений. С. П. Вуколов С. и его препараты Явления острого и хронического
Среднее содержание Серебра в земной коре (кларк) 7·10 -6 % по массе. Встречается преимущественно в средне- и низкотемпературных гидротермальных месторождениях, в зоне обогащения сульфидных месторождений, изредка - в осадочных породах (среди песчаников, содержащих углистое вещество) и россыпях. Известно свыше 50 минералов Серебра. В биосфере Серебро в основном рассеивается, в морской воде его содержание 3·10 -8 %. Серебро - один из наиболее дефицитных элементов.
Физические свойства Серебра. Серебро имеет гране-центрированную кубич. решетку (а = 4,0772 Å при 20 °С). Атомный радиус 1,44 Å, ионный радиус Ag + 1,13 Å. Плотность при 20 °С 10,5 г/см 3 ; t пл 960,8 °С; T кип 2212 °С; теплота плавления 105 кДж/кг (25,1 кал/г). Серебро обладает наивысшими среди металлов удельной электропроводностью 6297 сим/м (62,97 ом -1 ·см -1) при 25 °С, теплопроводностью 407,79 Вт/(м·К.) при 18 °С и отражательной способностью 90-99% (при длинах волн 100000-5000 Å). Удельная теплоемкость 234,46 дж/(кг·К) , удельное электросопротивление 15,9 ном·м (1,59 мком·см) при 20 °С. Серебро диамагнитно с атомной магнитной восприимчивостью при комнатной температуре -21,56·10 -6 , модуль упругости 76480 Мн/м 2 (7648 кгс/мм 2), предел прочности 100 Мн/м 2 (10 кгс/мм 2), твердость по Бринеллю 250 Мн/м 2 (25 кгс/мм 2). Конфигурация внешних электронов атома Ag 4d 10 5s 1 .
Химические свойства Серебра. Серебро проявляет химические свойства, характерные для элементов Iб подгруппы периодической системы Менделеева. В соединениях обычно одновалентно.
Серебро находится в конце электрохимического ряда напряжений, его нормальный электродный потенциал Ag = Ag + + e - равен 0,7978 в.
При обычной температуре Ag не взаимодействует с О 2 , N 2 и Н 2 . При действии свободных галогенов и серы на поверхности Серебра образуется защитная пленка малорастворимых галогенидов и сульфида Ag 2 S (кристаллы серо-черного цвета). Под влиянием сероводорода H 2 S, находящегося в атмосфере, на поверхности серебряных изделий образуется Ag 2 S в виде тонкой пленки, чем объясняется потемнение этих изделий. Сульфид можно получить действием сероводорода на растворимые соли Серебра или на водные суспензии его солей. Растворимость Ag 2 S в воде 2,48·10 -3 моль/л (25 °С). Известны аналогичные соединения - селенид Ag 2 Se и теллурид Ag 2 Te.
Из оксидов Серебра устойчивыми являются оксид (I) Ag 2 O и оксид (II) AgO. Оксид (I) образуется на поверхности Серебра в виде тонкой пленки в результате адсорбции кислорода, которая увеличивается с повышением температуры и давления.
Ag 2 O получают действием КОН на раствор AgNO 3 . Растворимость Ag 2 O в воде - 0,0174 г/л. Суспензия Ag 2 O обладает антисептическими свойствами. При 200 °С оксид Серебра (I) разлагается. Водород, оксид углерода (II), многие металлы восстанавливают Ag 2 O до металлического Ag. Озон окисляет Ag 2 O с образованием AgO. При 100 °С AgO разлагается на элементы со взрывом. Серебро растворяется в азотной кислоте при комнатной температуре с образованием AgNO 3 . Горячая концентрированная серная кислота растворяет Серебро с образованием сульфата Ag 2 SO 4 (растворимость сульфата в воде 0,79% по массе при 20 °С). В царской водке Серебро не растворяется из-за образования защитной пленки AgCl. В отсутствие окислителей при обычной температуре НCl, HBr, HI не взаимодействуют с Серебром благодаря образованию на поверхности металла защитной пленки малорастворимых галогенидов. Большинство солей Серебра, кроме AgNO 3 , AgF, AgClO 4 , обладают малой растворимостью. Серебро образует комплексные соединения, большей частью растворимые в воде. Многие из них имеют практическое значение в химические технологии и аналитической химии, например комплексные ионы - , + , - .
Получение Серебра. Большая часть Серебра (около 80%) извлекается попутно из полиметаллических руд, а также из руд золота и меди. При извлечении Серебра из серебряных и золотых руд применяют метод цианирования - растворения Серебра в щелочном растворе цианида натрия при доступе воздуха:
2Ag + 4NaCN + ½O 2 + H 2 O = 2Na + 2NaOH.
Из полученных растворов комплексных цианидов Серебро выделяют восстановлением цинком или алюминием:
2 - + Zn = 2- + 2Ag.
Из медных руд Серебро выплавляют вместе с черновой медью и затем выделяют его из анодного шлама, образующегося при электролитической очистке меди. При переработке свинцово-цинковых руд Серебро концентрируется в сплавах свинца - черновом свинце, из которого его извлекают добавлением металлического цинка, образующего с Серебром нерастворимое в свинце тугоплавкое соединение Ag 2 Zn 3 , всплывающее на поверхность свинца в виде легко снимающейся пены.
Применение Серебра. Серебро используют преимущественно в виде сплавов: из них чеканят монеты, изготовляют бытовые изделия, лабораторную и столовую посуду. Серебро покрывают радиодетали для придания им лучшей электропроводности и коррозионной стойкости; в электротехнической промышленности применяются серебряные контакты. Для пайки титана и его сплавов используются серебряные припои; в вакуумной технике Серебро служит конструкционным материалом. Металлическое Серебро идет на изготовление электродов для серебряно-цинковых и серебряно-кадмиевых аккумуляторов. Оно служит катализатором в неорганических и органических синтезе (например, в процессах окисления спиртов в альдегиды и кислоты, а также этилена в окись этилена). В пищевой промышленности применяются серебряные аппараты, в которых приготовляют фруктовые соки. Ионы Серебра в малых концентрациях стерилизуют воду. Соединения Серебра (AgBr, AgCl, AgI) применяются для производства кино- и фотоматериалов.
Серебро в искусстве. Благодаря красивому белому цвету и податливости в обработке Серебро с глубокой древности широко используется в искусстве. Однако чистое Серебро слишком мягко, поэтому при изготовлении монет и различных художественных произведений в него добавляют цветные металлы, чаще всего медь. Средствами обработки Серебра и украшения изделий из него служат чеканка, литье, филигрань, тиснение, применение эмалей, черни, гравировки, золочения.
Высокая культура художественной обработки Серебра характерна для искусства эллинистического мира, Древнего Рима, Древнего Ирана (сосуды эпохи Сасанидов, 3-7 века), средневековой Европы. Разнообразием форм, выразительностью силуэтов, мастерством фигурной и орнаментальной чеканки и литья отличаются изделия из Серебра, созданные мастерами Возрождения и барокко (Б. Челлини в Италии, ювелиры из семейств Ямницеров, Ленкеров, Ламбрехтов и других в Германии). В 18 - начале 19 вв. ведущая роль в производстве изделий из серебра переходит к Франции (К. Баллен, Т.Жермен, Р. Ж. Огюст и других). В искусстве 19-20 веков преобладает мода на незолоченое серебро; среди технических приемов доминирующее положение занимает литье, распространяются машинные приемы обработки. В русском искусстве 19 - начала 20 вв. выделяются изделия фирм Грачевых, П. А. Овчинникова, П. Ф. Сазикова, П. К. Фаберже, И. П. Хлебникова. Творческое развитие традиций ювелирного искусства прошлого, стремление наиболее полно выявить декоративные качества Серебра характерны для советских изделий из Серебра, среди которых видное место занимают произведения народных мастеров.
Серебро в организме. Серебро - постоянная составная часть растений и животных. Его содержание составляет в среднем в морских растениях 0,025 мг на 100 г сухого вещества, в наземных - 0,006 мг;, в морских животных - 0,3-1,1 мг, в наземных - следовые количества (10 -2 -10 -4 мг).
У животных накапливается в некоторых эндокринных железах, пигментной оболочке глаза, в эритроцитах; выводится главным образом с фекалиями. Серебро в организме образует комплексы с белками (глобулинами крови, гемоглобином и других). Блокируя сульфгидрилъные группы, участвующие в формировании активного центра ферментов, Серебро вызывает ингибирование последних, в частности инактивирует аденозинтрифосфатазную активность миозина. При парентеральном введении Серебро фиксируется в зонах воспаления; в крови связывается преимущественно глобулинами сыворотки.
Препараты Серебра обладают антибактериальным, вяжущим и прижигающим действием, что связано с их способностью нарушать ферментные системы микроорганизмов и осаждать белки. В медицинской практике наиболее часто применяют нитрат серебра, колларгол, протаргол (в тех же случаях, что и колларгол); бактерицидную бумагу (пористая бумага, пропитанная нитратом и хлоридом Серебра) применяют при небольших ранах, ссадинах, ожогах и т. п.
Экономическое значение Серебра. Серебро в условиях товарного производства выполняло функцию всеобщего эквивалента наряду с золотом и приобрело, как и последнее, особую потребительную стоимость - стало деньгами. Товарный мир выделил Серебро в качестве денег потому, что оно обладает важными для денежных товаров свойствами: однородностью, делимостью, сохраняемостью, портативностью (высокой стоимостью при небольших объеме и массе), легко поддается обработке.
Первоначально Серебро обращалось в форме слитков. В странах Древнего Востока (Ассирия, Вавилон, Египет), а также в Греции и Риме Серебро было широко распространенным денежным металлом наряду с золотом и медью. В Древнем Риме чеканка монет из Серебра начата в 4-3 веках до нашей эры. Чеканка первых древнерусских монет из Серебра началась в 9-10 веках.
В период раннего средневековья преобладала чеканка золотой монеты. С 16 века в связи с недостатком золота, расширением добычи Серебра в Европе и притоком его из Америки (Перу и Мексики) Серебро стало основным денежным металлом в странах Европы. В эпоху первоначального накопления капитала почти во всех странах существовал серебряный монометаллизм или биметаллизм. Золотые и серебряные монеты обращались по действительной стоимости содержавшегося в них благородного металла, причем ценностное соотношение между этими металлами складывалось стихийно, под влиянием рыночных факторов. В конце 18 - начале 19 вв. на смену системе параллельной валюты пришла система двойной валюты, при которой государство в законодательном порядке устанавливало обязательное соотношение между золотом и Серебром. Однако эта система оказалась чрезвычайно неустойчивой, так как в условиях стихийного действия закона стоимости неизбежно возникало несоответствие между рыночными и фиксированными стоимостями золота и Серебра. В конце 19 века стоимость Серебра резко снизилась вследствие совершенствования способов его добычи из полиметаллических руд (в 70-80-е годы 19 века отношение стоимости золота к Серебру составляло 1:15 - 1:16, в начале 20 века уже 1:38 - 1:39). Рост мировой добычи золота ускорил процесс вытеснения обесценившегося Серебра из обращения. В последней четверти 19 века широкое распространение в мире получил золотой монометаллизм. В большинстве стран мира вытеснение серебряной валюты золотой закончилось в начале 20 века. Серебряная валюта сохранилась примерно до середины 30-х годов 20 века в ряде стран Востока (Китай, Иран, Афганистан и других). С отходом этих стран от серебряного монометаллизма Серебро окончательно утратило значение валютного металла. В промышленно развитых странах Серебро используется только для чеканки разменной монеты.
Рост использования Серебра в технических целях, в зубоврачебном деле, в медицине, а также в производстве ювелирных изделий после 2-й мировой войны 1939-45 годов в условиях отставания добычи Серебра от потребностей рынка вызвал его нехватку. До войны около 75% добываемого Серебра ежегодно использовалось для монетарных целей. В 1950-65 годах этот показатель снизился в среднем до 50%, а в последующие годы продолжал снижаться, составив в 1971 году всего 5% . Многие страны перешли к использованию в качестве монетарного материала медно-никелевых сплавов. Хотя серебряные монеты все еще находятся в обращении, чеканка новых монет из Серебра во многих странах запрещена, а в некоторых значительно уменьшено его содержание в монетах. В США, например, согласно закону о чеканке монет, принятому в 1965, около 90% Серебра, которое шло раньше для чеканки монет, выделено для других целей. Содержание Серебра в 50-центовой монете снижено с 90 до 40%, а монеты достоинством в 10 и 25 центов, содержавшие ранее 90% Серебра, чеканятся без примесей Серебра. Новые монеты из Серебра чеканятся в связи с различными памятными событиями (Олимпийскими играми, юбилеями, мемориалами и т. д.).
Основными потребителями Серебра являются следующие отрасли: производство ювелирных изделий (столового Серебро и анодированных изделий), электротехническая и электронная промышленность, а также кинофотопромышленность.