В зависимости от свойств объекта свет изменяет свои физические свойства - цвет (длину волны), яркость (амплитуду волны), фазу, используются в современных микроскопах для создания контраста.
Рис. 1. Микроскоп МБИ-3: 1 - ножка, или башмак; 2 - барашки грубого движения тубуса; 3 - тубусодержатель; 4 - окуляры; 5 - бинокулярная насадка; 6 - головка для крепления револьвера с посадочным гнездом для смены тубусов; 7 - винт крепления бинокулярной насадки; 8 - револьвер на салазках; 9 - объективы; 10 - предметный столик; 11 - барашек продольного движения препаратодержателя; 12 - барашек поперечного движения препаратодержателя; 13 - апланатический конденсор прямого и косого освещения; 14 - центрировочные винты столика; 15 - головка винта, фиксирующего верхнюю часть предметного столика; 16 - кронштейн конденсора; 17 - барашек микромеханизма; 18 - зеркало; 19 - коробка с микромеханизмом.
Наиболее легко поддаются окрашиванию фиксированные, убитые препараты. Такие неподвижные препараты могут быть с высокой точностью рассмотрены и сфотографированы через микроскоп, но они не дают возможности оценить различные формы жизнедеятельности микроскопируемого объекта (движение, слияние, фагоцитоз и пр.). Известны красители, которые связываются с живыми клетками, не нарушая их жизнедеятельности.
Витальная (прижизненная) микроскопия показывает, что многие структуры живой клетки сравнительно мало изменяются при умелой фиксации и последующем окрашивании. Этим подтверждается высокая научная ценность информации, получаемой при помощи микроскопии окрашенных объектов. Витальная микроскопия возможна и без окрашивания, если в обычный микроскоп ввести так называемый темнопольный конденсор. Он освещает объект так, что в глаз наблюдателя попадают только те лучи, которые рассеялись на частицах объекта и тем самым изменили направление своего распространения. Лучи, прошедшие через фон без рассеяния, в глаз не попадают. Поэтому частицы объекта светятся и ярко выделяются на темном фоне (темном поле). Частицы объекта хорошо видны, даже если их размеры меньше разрешаемого расстояния.
Темнопольная микроскопия обеспечивает наибольший возможный контраст изображения, но четкость его и полезное увеличение заметно ниже, чем при обычной микроскопии. Темнопольная микроскопия успешно применялась для изучения спирохет, лептоспир и других слабо окрашиваемых микроорганизмов. При работе с гистологическими препаратами она неприменима.
Технически самостоятельным вариантом темнопольной микроскопии является ультрамикроскопия , при которой мельчайшие изучаемые частицы освещаются мощным боковым пучком света и видны точками на черном фоне. Ультрамикроскопия позволяет подсчитывать частицы, оценивать их размеры и другие свойства. Применяется для изучения коллоидных растворов, аэрозолей, суспензий.
В последние годы темнопольная микроскопия применяется все реже, так как появились два новых типа контрастирующих приборов со значительно лучшими характеристиками - фазово-контрастный (рис. 2, а и б) и амплитудно-контрастный микроскопы. Технически они сходны, но в них используют различные изменения светового луча в объекте. Луч, прошедший через фон образца, в идеальном случае не претерпевает никаких изменений. Он проходит через точно определенные участки объектива. Луч, прошедший через объект, подвергается дифракции, т. е. распадается на пучки убывающей интенсивности, которые выходят из объекта под разными углами. Другие свойства луча (амплитуда, длина волны, фаза) изменяются в различных степенях в зависимости от особенностей объекта.

Рис. 2. Микроскоп МБИ-3 (а) с фазово-контрастным устройством КФ-1 (б): 1 - конденсор револьверной системы; г - набор объективов и кольцевых диафрагм; 3 - вспомогательный микроскоп.
Почти все живые микроскопические объекты выглядят в обычном микроскопе едва заметными, прозрачными, потому что они почти не изменяют ни амплитуды, ни цвета прошедшего через них луча.
Они изменяют только фазу его волны, но это изменение не улавливается ни глазом, ни фотопластинкой. Пучок лучей, дифрагированных объектом и сдвинутых им по фазе, проходит через те участки объектива, где не могут пройти прямые, недифрагированные лучи фона. Практически нетрудно определить, где именно пройдут эти лучи. Если накрыть этот участок одной из линз объектива полупрозрачной пластинкой, способной изменить фазу, интенсивность, цвет или все эти три свойства вместе, то изображение фона изменит свою фазу, уменьшится его яркость или преобразится цвет. Лучи, прошедшие через объект и отклоненные (дифрагированные) им, обойдут вложенную в объектив пластинку и, следовательно, не приобретут тех свойств, которые приобрели, пройдя через пластинку, лучи фона. В результате разница между лучами фона и объекта возрастет. Если разница фаз между лучами фона и объекта достигает 1/4 длины волны, то в конечном изображении возникает заметный для глаза и фотопластинки контраст: темный объект на светлом фоне или, наоборот, в зависимости от структуры пластинки, которую в этом случае называют «фазовой». Если же пластинка изменяет главным образом яркость и цвет фона, то такой микроскоп следует назвать амплитудно-контрастным (большое распространение получило более короткое, хотя и не совсем правильное название «аноптральный»). Таким образом, разница между фазово-контрастным и амплитудно-контрастным микроскопом определяется свойствами пластинки в объективе, изменяющей свойства недифрагированных лучей фона. Изображения, построенные этими микроскопами, значительно ярче и богаче деталями (рис. 3 и 4), чем темнопольные картины.
Рис. 3. Культура многоклеточной бактерии Caryophanon latum Peshkoff. Амплитудно-контрастная микроскопия.
Рис. 4. Микроколонии Вас. megatherium, зараженной фагом. Амплитудно-контрастная микроскопия.
С появлением фазово- и амплитудно-контрастных микроскопов витальная микроскопия получила прекрасную технико-методическую базу, возможности которой близки к предельным для световой оптики. Никакой фиксации или окраски объекта эти приборы не требуют. Современная витальная микроскопия чрезвычайно расширила наши знания о поведении и динамике живых микрообъектов в естественных и лабораторных условиях обитания и эксперимента. Ускоренная (рапид) и замедленная (цейтрафферная) микрокиносъемка сделали доступными для исследования процессы, скорость течения которых слишком велика или слишком мала для визуального наблюдения.
Выпускаемые промышленностью фазово-контрастные и амплитудно-контрастные (аноптральные) устройства недороги, легко монтируются на серийных микроскопах; использование их не представляет затруднений. Эти приборы, несомненно, будут находить все новые области применения как в научных исследованиях, так и в медицинской практике.
Ультрафиолетовая микроскопия основана на способности некоторых веществ избирательно поглощать ультрафиолетовые лучи с определенной длиной волны. Это позволяет наглядно демонстрировать и изучать, в том числе количественно, распределение веществ в живых клетках или фиксированных препаратах. Так, например, белки и нуклеиновые кислоты одинаково прозрачны для видимого света; рассматривая неокрашенную клетку в видимом свете, нельзя определить, где расположен белок или нуклеиновая кислота. Но ультрафиолетовые лучи определенной длины нуклеиновая кислота поглощает значительно сильнее, чем белок. Поэтому в ультрафиолетовом микроскопе участок, содержащий нуклеиновую кислоту, выглядит значительно темнее. Так как ультрафиолетовые лучи непосредственно глазом не воспринимаются, приходится применять специальные преобразователи света. Ультрафиолетовая микроскопия технически значительно сложнее обычной световой, ее аппаратура дороже и методика тоньше. Несмотря на это, применение ее оправдано, так как научная значимость быстрого топографического описания химического состава живой клетки весьма велика.
Гораздо более доступна и перспективна люминесцентная микроскопия (см.), широко применяемая ныне в научно-исследовательских и клинико-диагностических лабораториях. При этом живой объект обрабатывают специальными красителями, которые, будучи освещены синим, фиолетовым или ультрафиолетовым светом, начинают светиться, излучая более длинные волны (зеленые, желтые). Цвет возбужденного вторичного свечения зависит от химических свойств объекта и введенного в него красителя.
Поляризационная микроскопия основана на изменении плоскости колебаний световой волны после прохождения через кристаллы. В практической медицине не применяется.
Современная микроскопия требует применения разнообразной вспомогательной аппаратуры. Нагревательные столики и термостаты позволяют выдерживать и наблюдать объект длительное время при заданной температуре. Для длительного выращивания микробов или тканевых культур в поле зрения сильного объектива служат разнообразные микрокамеры. Окулярные и объективные микрометры делают возможными точные измерения микрообъектов. Промышленность выпускает микроманипуляторы (см.) для операций на микрообъектах. Для получения стереоскопического изображения при увеличениях до 100 раз предназначены бинокулярные лупы (см.) и стереомикроскопы (рис. 5). Широко производится и используется аппаратура для микрофотографии и микрокиносъемки (рис. 6). См. также Микроскопическая техника.

Рис. 5. Стереоскопический микроскоп МБС-1.

Рис. 6. Микрокиноустановка МКУ-1.
Отправить свою хорошую работу в базу знаний просто. Используйте форму, расположенную ниже
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Размещено на http://www.allbest.ru/
Реферат на тему:
Современные методы микроскопических исследований
Выполнила ученица
2го курса 12 группы
Щукина Серафима Сергеевна
Введение
1. Виды микроскопии
1.1 Световая микроскопия
1.2 Фазово-контрастная микроскопия
1.3 Интерференционная микроскопия
1.4 Поляризационная микроскопия
1.5 Люминесцентная микроскопия
1.6 Ультрафиолетовая микроскопия
1.7 Инфракрасная микроскопия
1.8 Стереоскопическая микроскопия
1.9 Электронная микроскопия
2. Некоторые виды современных микроскопов
2.1 Историческая справка
2.2 Основные узлы микроскопа
2.3 Типы микроскопа
Заключение
Список использованной литературы
Введение
Микроскопические методы исследования - способы изучения различных объектов с помощью микроскопа. В биологии и медицине эти методы позволяют изучать строение микроскопических объектов, размеры которых лежат за пределами разрешающей способности глаза человека. Основу микроскопических методов исследования (М.м.и.) составляет световая и электронная микроскопия. В практической и научной деятельности врачи различных специальностей - вирусологи, микробиологи, цитологи, морфологи, гематологи и др. помимо обычной световой микроскопии используют фазово-контрастную, интерференционную, люминесцентную, поляризационную, стереоскопическую, ультрафиолетовую, инфракрасную микроскопию. В основе этих методов лежат различные свойства света. При электронной микроскопии изображение объектов исследования возникает за счет направленного потока электронов.
микроскопия поляризационный ультрафиолетовый
1. Виды микроскопии
1.1 Световая микроскопия
Для световой микроскопии и основанных на ней других М.м.и. определяющее значение помимо разрешающей способности микроскопа имеет характер и направленность светового луча, а также особенности изучаемого объекта, который может быть прозрачным и непрозрачным. В зависимости от свойств объекта изменяются физические свойства света - его цвет и яркость, связанные с длиной и амплитудой волны, фаза, плоскость и направление распространения волны. На использовании этих свойств света и строятся различные М. м. и. Для световой микроскопии биологические объекты обычно окрашивают с целью выявления тех или иных их свойств (рис. 1 ). При этом ткани должны быть фиксированы, т. к. окраска выявляет определенные структуры только убитых клеток. В живой клетке краситель обособляется в цитоплазме в виде вакуоли и не прокрашивает ее структуры. Однако в световом микроскопе можно изучать и живые биологические объекты с помощью метода витальной микроскопии. В этом случае применяют темнопольный конденсор, который встраивают в микроскоп.
Рис. 1. Микропрепарат миокарда при внезапной смерти от острой коронарной недостаточности: окраска по Ли позволяет выявить контрактурные пересокращения миофибрилл (участки красного цвета); Ч250.
1.2 Фазово-контрастная микроскопия
Для исследования живых и неокрашенных биологических объектов используют также фазово-контрастную микроскопию. Она основана на дифракции луча света в зависимости от особенностей объекта излучения. При этом изменяется длина и фаза световой волны. Объектив специального фазово-контрастного микроскопа содержит полупрозрачную фазовую пластинку. Живые микроскопические объекты или фиксированные, но не окрашенные, микроорганизмы и клетки из-за их прозрачности практически не изменяют амплитуду и цвет проходящего через них светового луча, вызывая лишь сдвиг фазы его волны. Однако, пройдя через изучаемый объект, лучи света отклоняются от полупрозрачной фазовой пластинки. В результате между лучами, прошедшими через объект, и лучами светового фона возникает разность длины волны. Если эта разность составляет не менее 1/4 длины волны, то появляется зрительный эффект, при котором темный объект отчетливо виден на светлом фоне или наоборот в зависимости от особенностей фазовой пластинки.
1.3 Интерференционная микроскопия
Интерференционная микроскопия решает те же задачи, что и фазово-контрастная. Но если последняя позволяет наблюдать лишь контуры объектов исследования, то с помощью интерференционной микроскопии можно изучать детали прозрачного объекта и проводить их количественный анализ. Это достигается благодаря раздвоению луча света в микроскопе: один из лучей проходит через частицу наблюдаемого объекта, а другой мимо нее. В окуляре микроскопа оба луча соединяются и интерферируют между собой. Возникающую разность фаз можно измерить, определив т. о. массу различных клеточных структур. Последовательное измерение разности фаз света с известными показателями преломления дает возможность определять толщину живых объектов и нефиксированных тканей, концентрацию в них воды и сухого вещества, содержание белков и т. д. На основании данных интерференционной микроскопии можно косвенно судить о проницаемости мембран, активности ферментов, клеточном метаболизме объектов исследования.
1.4 Поляризационная микроскопия
Поляризационная микроскопия позволяет изучать объекты исследования в свете, образованном двумя лучами, поляризованными во взаимноперпендикулярных плоскостях, т. е. в поляризованном свете. Для этого используют пленчатые поляроиды или призмы Николя, которые помещают в микроскопе между источником света и препаратом. Поляризация меняется при прохождении (или отражении) лучей света через различные структурные компоненты клеток и тканей, свойства которых неоднородны. В так называемых изотропных структурах скорость распространения поляризованного света не зависит от плоскости поляризации, в анизотропных структурах скорость его распространения меняется в зависимости от направления света по продольной или ванном свете в норме.
Рис. 2а). Микропрепарат миокарда в поляризо поперечной оси объекта.
Если показатель преломления света вдоль структуры больше, чем в поперечном направлении, возникает положительное двойное лучепреломление, при обратных взаимоотношениях - отрицательное двойное лучепреломление. Многие биологические объекты имеют строгую молекулярную ориентацию, являются анизотропными и обладают положительным двойным преломлением света. Такими свойствами обладают миофибриллы, реснички мерцательного эпителия, нейрофибриллы, коллагеновые волокна и др. Сопоставление характера преломления лучей поляризованного света и величины анизотропии объекта позволяет судить о молекулярной организации его структуры (рис.2 ).Поляризационная микроскопия является одним из гистологических методов исследования, способом микробиологической диагностики, находит применение в цитологических исследованиях и др. При этом в поляризованном свете можно исследовать как окрашенные, так и неокрашенные и нефиксированные, так называемые нативные препараты срезов тканей.
Рис. 2б). Микропрепарат миокарда в поляризованном свете при внезапной смерти от острой коронарной недостаточности -- выявляются участки, в которых отсутствует характерная поперечная исчерченность кардиомиоцитов; Ч400.
1.5 Люминесцентная микроскопия
Широкое распространение имеет люминесцентная микроскопия. Она основана на свойстве некоторых веществ давать свечение - люминесценцию в УФ-лучах или в сине-фиолетовой части спектра. Многие биологические вещества, такие как простые белки, коферменты, некоторые витамины и лекарственные средства, обладают собственной (первичной) люминесценцией. Другие вещества начинают светиться только при добавлении к ним специальных красителей -- флюорохромов (вторичная люминесценция). Флюорохромы могут распределяться в клетке диффузно либо избирательно окрашивают отдельные клеточные структуры или определенные химические соединения биологического объекта. На этом основано использование люминесцентной микроскопии при цитологических и гистохимических исследованиях. С помощью иммуно-флюоресценции в люминесцентном микроскопе выявляют вирусные антигены и их концентрацию в клетках, идентифицируют вирусы, определяют антигены и антитела, гормоны, различные продукты метаболизма и т. д. (рис. 3 ). В связи с этим люминесцентную микроскопию применяют в лабораторной диагностике таких инфекций, как герпес, эпидемический паротит, вирусный гепатит, грипп и др., используют в экспресс диагностике респираторных вирусных инфекций, исследуя отпечатки со слизистой оболочки носа больных, и при дифференциальной диагностике различных инфекций. В патоморфологии с помощью люминесцентной микроскопии распознают злокачественные опухоли в гистологических и цитологических препаратах, определяют участки ишемии мышцы сердца при ранних сроках инфаркта миокарда, выявляют амилоид в биоптатах тканей.
Рис. 3. Микропрепарат перитонеального макрофага в клеточной культуре, люминесцентная микроскопия.
1.6 Ультрафиолетовая микроскопия
Ультрафиолетовая микроскопия основана на способности некоторых веществ, входящих в состав живых клеток, микроорганизмов или фиксированных, но не окрашенных, прозрачных в видимом свете тканей, поглощать УФ-излучение с определенной длиной волн (400- 250 нм). Этим свойством обладают высокомолекулярные соединения, такие как нуклеиновые кислоты, белки, ароматические кислоты (тирозин, триптофан, метилаланин), пуриновые и пирамидиновые основания и др. С помощью ультрафиолетовой микроскопии уточняют локализацию и количество указанных веществ, а в случае исследования живых объектов - их изменения в процессе жизнедеятельности.
1.7 Инфракрасная микроскопия
Инфракрасная микроскопия позволяет исследовать непрозрачные для видимого света и УФ-излучения объекты путем поглощения их структурами света с длиной волны 750--1200 нм. Для инфракрасной микроскопии не требуется предварительной хим. обработки препаратов. Этот вид М. м. и. наиболее часто используют в зоологии, антропологии, других отраслях биологии. В медицине инфракрасную микроскопию применяют в основном в нейроморфологии и офтальмологии.
1.8 Стереоскопическая микроскопия
Для исследования объемных объектов используют стереоскопическую микроскопию. Конструкция стереоскопических микроскопов позволяет видеть объект исследования правым и левым глазом под разными углами. Исследуют непрозрачные объекты при относительно небольшом увеличении (до 120 раз). Стереоскопическая микроскопия находит применение в микрохирургии, в патоморфологии при специальном изучении биопсийного, операционного и секционного материала, в судебно-медицинских лабораторных исследованиях.
1.9 Электронная микроскопия
Для изучения на субклеточном и макромолекулярном уровнях структуры клеток, тканей микроорганизмов и вирусов используют электронную микроскопию. Этот М. м. и. позволил перейти на качественно новый уровень изучения материи. Он нашел широкое применение в морфологии, микробиологии, вирусологии, биохимии, онкологии, генетике, иммунологии. Резкое повышение разрешающей способности электронного микроскопа обеспечивается потоком электронов, проходящих в вакууме через электромагнитные поля, создаваемые электромагнитными линзами. Электроны могут проходить через структуры исследуемого объекта (трансмиссионная электронная микроскопия) или отражаться от них (сканирующая электронная микроскопия), отклоняясь под разными углами, в результате чего возникает изображение на люминесцентном экране микроскопа. При трансмиссионной (просвечивающей) электронной микроскопии получают плоскостное изображение структур (рис. 4 ), при сканирующей - объемное (рис. 5 ). Сочетание электронной микроскопии с другими методами, например, с радиоавтографией, гистохимическими, иммунологическими методами исследования, позволяет проводить электронно-радиоавтографические, электронно-гистохимические, электронно-иммунологические исследования.
Рис. 4. Электронограмма кардиомиоцита, полученная при трансмиссионной (просвечивающей) электронной микроскопии: отчетливо видны субклеточные структуры; Ч22000.
Электронная микроскопия требует специальной подготовки объектов исследования, в частности химической или физической фиксации тканей и микроорганизмов. Биопсийный материал и секционный материал после фиксации обезвоживают, заливают в эпоксидные смолы, режут стеклянными или алмазными ножами на специальных ультратомах, позволяющих получать ультратонкие срезы тканей толщиной 30--50 нм. Их контрастируют и затем изучают в электронном микроскопе. В сканирующем (растровом) электронном микроскопе изучают поверхность различных объектов, напыляя на них в вакуумной камере электронно-плотные вещества, и исследуют так наз. реплики, повторяющие контуры образца.
Рис. 5. Электронограмма лейкоцита и фагоцитируемой им бактерии, полученная при сканирующей электронной микроскопии; Ч20000.
2. Некоторые виды современных микроскопов
Фазово-контрастный микроскоп (аноптральный микроскоп) служит для исследования прозрачных объектов, которые не видны на светлом поле и не подлежат окрашиванию из-за возникновения аномалий в исследуемых образцах.
Интерференционный микроскоп дает возможность исследовать объекты с низкими показателями преломления света и чрезвычайно малой толщины.
Ультрафиолетовый и инфракрасный микроскопы предназначены для исследования объектов в ультрафиолетовом или инфракрасном участке светового спектра. Они снабжены флюоресцентными экраном, на котором формируется изображение исследуемого препарата, фотокамерой с чувствительным к этим излучениям фотоматериалом или электронно-оптическим преобразователем для формирования изображения на экране осциллоскопа. Длина волны ультрафиолетовой части спектра составляет 400--250 нм, поэтому в ультрафиолетовом микроскопе можно получить более высокое разрешение, чем в световом, где освещение осуществляется видимым световым излучением с длиной волны 700--400 нм. Преимуществом этого М. является также то, что невидимые в обычном световом микроскопе объекты становятся видимыми, поскольку поглощают УФ-излучение. В инфракрасном микроскопе наблюдение объектов ведется на экране электронно-оптического преобразователя или фотографируется. С помощью инфракрасной микроскопии изучают внутреннюю структуру непрозрачных объектов.
Поляризационный микроскоп позволяет выявлять неоднородности (анизотропию) структуры при изучении строения тканей и образований в организме в поляризованном свете. Освещение препарата в поляризационном микроскопе осуществляется через поляризатор-пластинку, которая обеспечивает прохождение света в определенной плоскости распространения волн. Когда поляризованный свет, взаимодействуя со структурами, изменяется, то структуры резко контрастируют, что широко используют в медико-биологических исследованиях при изучении препаратов крови, гистологических препаратов, шлифов зубов, костей и т. д.
Люминесцентный микроскоп (МЛ-2, МЛ-3) предназначен для исследования люминесцирующих объектов, что достигается при освещении последних с помощью УФ-излучения. Наблюдая или фотографируя препараты в свете их видимой возбужденной флюоресценции (т. е. в отраженном свете), можно судить о структуре исследуемого образца, что используется в гистохимии, гистологии, микробиологии и при иммунологических исследованиях. Прямое окрашивание люминесцентными красителями позволяет более четко выявлять такие структуры клеток, которые трудно рассмотреть в световом микроскопе.
Рентгеновский микроскоп используется для исследования объектов в рентгеновском излучении, поэтому такие микроскопов снабжены микрофокусным рентгеновским источником излучения, преобразователем рентгеновского изображения в видимое -- электронно-оптическим преобразователем, формирующим видимое изображение на осциллографической трубке или на фотопленке. Рентгеновские микроскопы имеют линейное разрешение до 0,1 мкм, что позволяет исследовать тонкие структуры живого вещества.
Электронный микроскоп предназначен для исследования сверхтонких структур, неразличимых в световых микроскопах. В отличие от светового, в электронном микроскопе разрешение определяется не только явлениями дифракции, но и различными аберрациями электронных линз, которые практически невозможно корригировать. Наводка микроскопа, в основном, производится диафрагмированием за счет применения малых апертур электронных пучков.
2.1 Историческая справка
Свойство системы из двух линз давать увеличенные изображения предметов было известно уже в 16 в. в Нидерландах и Северной Италии мастерам, изготовлявшим очковые стекла. Имеются сведения, что около 1590 прибор типа М. был построен З. Янсеном (Нидерланды). Быстрое распространение М. и их совершенствование, главным образом ремесленниками-оптиками, начинается с 1609--10, когда Г. Галилей, изучая сконструированную им зрительную трубу (см. Зрительная труба), использовал её и в качестве М., изменяя расстояние между объективом и окуляром. Первые блестящие успехи применения М. в научных исследованиях связаны с именами Р. Гука (около 1665; в частности, он установил, что животные и растительные ткани имеют клеточное строение) и особенно А. Левенгука, открывшего с помощью М. микроорганизмы (1673--77). В начале 18 в. М. появились в России: здесь Л. Эйлер (1762; «Диоптрика», 1770--71) разработал методы расчёта оптических узлов М. В 1827 Дж. Б. Амичи впервые применил в М. иммерсионный объектив. В 1850 английский оптик Г. Сорби создал первый М. для наблюдения объектов в поляризованном свете.
Широкому развитию методов микроскопических исследований и совершенствованию различных типов М. во 2-й половине 19 и в 20 вв. в значительной степени способствовала научная деятельность Э. Аббе, который разработал (1872--73) ставшую классической теорию образования изображений несамосветящихся объектов в М. Английский учёный Дж. Сиркс в 1893 положил начало интерференционной микроскопии. В 1903 австр. исследователи Р. Зигмонди и Г. Зидентопф создали т. н. ультрамикроскоп. В 1935 Ф. Цернике предложил метод фазового контраста для наблюдения в М. прозрачных слабо рассеивающих свет объектов. Большой вклад в теорию и практику микроскопии внесли сов. учёные -- Л. И. Мандельштам, Д. С. Рождественский, А. А. Лебедев, В. П. Линник.
2.2 Основные узлы микроскопа
В большинстве типов М. (за исключением инвертированных, см. ниже) над предметным столиком, на котором закрепляют препарат, располагается устройство для крепления объективов, а под столиком устанавливается конденсор. Любой М. имеет тубус (трубку), в котором устанавливаются окуляры; обязательной принадлежностью М. являются также механизмы для грубой и точной фокусировки (осуществляемой путём изменения относительного положения препарата, объектива и окуляра). Все эти узлы крепятся на штативе или корпусе М.
Тип применяемого конденсора зависит от выбора метода наблюдения. Светлопольные конденсоры и конденсоры для наблюдения по методу фазового или интерференционного контраста представляют собой сильно отличающиеся одна от другой двух- или трёхлинзовые системы. У светлопольных конденсоров числовая апертура может достигать 1,4; в их состав входит апертурная Ирисовая диафрагма, которая иногда может смещаться в сторону для получения косого освещения препарата. Фазово-контрастные конденсоры снабжены кольцевыми диафрагмами. Сложными системами из линз и зеркал являются темнопольные конденсоры. Отдельную группу составляют эпиконденсоры -- необходимые при наблюдении по методу тёмного поля в отражённом свете системы кольцеобразных линз и зеркал, устанавливаемых вокруг объектива. В УФ микроскопии применяются специальные зеркально-линзовые и линзовые конденсоры, прозрачные для ультрафиолетовых лучей.
Объективы в большинстве современных М. сменные и выбираются в зависимости от конкретных условий наблюдения. Часто несколько объективов закрепляются в одной вращающейся (т. н. револьверной) головке; смена объектива в этом случае осуществляется простым поворотом головки. По степени исправления хроматической аберрации (см. Хроматическая аберрация) различают микрообъективы Ахроматы и апохроматы (см. Ахромат). Первые наиболее просты по устройству; хроматическая аберрация в них исправлена только для двух длин волн, и изображение при освещении объекта белым светом остаётся слегка окрашенным. В апохроматах эта аберрация исправлена для трёх длин волн, и они дают бесцветные изображения. Плоскость изображения у ахроматов и апохроматов несколько искривлена (см. Кривизна поля). Аккомодация глаза и возможность просмотра всего поля зрения с помощью перефокусировки М. отчасти компенсируют этот недостаток при визуальном наблюдении, однако он сильно сказывается при микрофотографировании -- крайние участки изображения получаются нерезкими. Поэтому широко используют микрообъективы с дополнительным исправлением кривизны поля -- планахроматы и планапохроматы. В сочетании с обычными объективами применяют специальные проекционные системы -- гомали, вставляемые вместо окуляров и исправляющие кривизну поверхности изображения (для визуального наблюдения они непригодны).
Кроме того, микрообъективы различаются: а) по спектральным характеристикам -- на объективы для видимой области спектра и для УФ и ИК микроскопии (линзовые или зеркально-линзовые); б) по длине тубуса, на которую они рассчитаны (в зависимости от конструкции М.), -- на объективы для тубуса 160 мм, для тубуса 190 мм и для т. н. «длины тубуса бесконечность» (последние создают изображение «на бесконечности» и применяются совместно с дополнительной -- т. н. тубусной -- линзой, переводящей изображение в фокальную плоскость окуляра); в) по среде между объективом и препаратом -- на сухие и иммерсионные; г) по методу наблюдения -- на обычные, фазово-контрастные, интерференционные и др.; д) по типу препаратов -- для препаратов с покровным стеклом и без него. Отдельный тип представляют собой эпиобъективы (сочетание обычного объектива с эпиконденсором). Многообразие объективов обусловлено разнообразием методов микроскопических наблюдений и конструкций М., а также различиями в требованиях к исправлению аберраций в разных условиях работы. Поэтому каждый объектив можно применять только в тех условиях, для которых он рассчитан. Например, объективом, рассчитанным для тубуса 160 мм, нельзя пользоваться в М. с длиной тубуса 190 мм; с объективом для препаратов с покровным стеклом нельзя наблюдать препараты без покровного стекла. Особенно важно соблюдать расчётные условия при работе с сухими объективами больших апертур (А > 0,6), которые очень чувствительны ко всяким отклонениям от нормы. Толщина покровных стекол при работе с этими объективами должна быть равна 0,17 мм. Иммерсионный объектив можно использовать только с той иммерсией, для которой он рассчитан.
Тип применяемого окуляра при данном методе наблюдения определяется выбором объектива М. С ахроматами малых и средних увеличении используют окуляры Гюйгенса, с апохроматами и ахроматами больших увеличений -- т. н. компенсационные окуляры, рассчитываемые так, чтобы их остаточная хроматическая аберрация была другого знака, чем у объективов, что улучшает качество изображения. Кроме того, существуют специальные фотоокуляры и проекционные окуляры, которые проектируют изображение на экран или фотопластинку (сюда же можно отнести упомянутые выше гомали). Отдельную группу составляют кварцевые окуляры, прозрачные для УФ лучей.
Разнообразные принадлежности к М. позволяют улучшить условия наблюдения и расширить возможности исследований. Осветители различных типов предназначены для создания наилучших условий освещения; окулярные микрометры (см. Окулярный микрометр) служат для измерения размеров объектов; бинокулярные тубусы дают возможность наблюдать препарат одновременно двумя глазами; микрофотонасадки и микрофотоустановки применяются при микрофотографии; рисовальные аппараты дают возможность зарисовывать изображения. Для количественных исследований применяются специальные устройства (например, микроспектрофотометрические насадки).
2.3 Типы микроскопов
Конструкция М., его оснащение и характеристики основных узлов определяются либо областью применения, кругом проблем и характером объектов, для исследования которых он предназначен, либо методом (методами) наблюдения, на которые он рассчитан, либо же и тем и другим вместе. Всё это привело к созданию различных типов специализированных М., позволяющих с высокой точностью изучать строго определённые классы объектов (или даже только некоторые определённые их свойства). С другой стороны, существуют т. н. универсальные М., с помощью которых можно различными методами наблюдать различные объекты.
Биологические М. относятся к числу наиболее распространённых. Они применяются для ботанических, гистологических, цитологических, микробиологических, медицинских исследований, а также в областях, не связанных непосредственное биологией, -- для наблюдения прозрачных объектов в химии, физике и т. д. Существует много моделей биологических М., отличающихся конструктивным оформлением и дополнительными принадлежностями, которые существенно расширяют круг изучаемых объектов. К этим принадлежностям относятся: сменные осветители проходящего и отражённого света; сменные конденсоры для работы по методам светлого и тёмного полей; фазово-контрастные устройства; окулярные микрометры; микрофотонасадки; наборы светофильтров и поляризационных устройств, позволяющие в обычном (неспециализированном) М. применять технику люминесцентной и поляризационной микроскопии. Во вспомогательном оборудовании для биологическиого М. особенно важную роль играют средства микроскопической техники (см. Микроскопическая техника), предназначенные для подготовки препаратов и проведения с ними различных операций, в том числе и непосредственно в процессе наблюдения (см. Микроманипулятор, Микротом).
Биологические исследовательские М. оснащаются набором сменных объективов для различных условий и методов наблюдения и типов препаратов, в том числе эпиобъективами для отражённого света и зачастую фазово-контрастными объективами. Набору объективов соответствует комплект окуляров для визуального наблюдения и микрофотографирования. Обычно такие М. имеют бинокулярные тубусы для наблюдения двумя глазами.
Кроме М. общего назначения, в биологии широко используются и различные М., специализированные по методу наблюдения (см. ниже).
Инвертированные М. отличаются тем, что объектив в них располагается под наблюдаемым предметом, а конденсор -- сверху. Направление хода лучей, прошедших сверху вниз через объектив, изменяется системой зеркал, и в глаз наблюдателя они попадают, как обычно, снизу вверх (рис. 8 ). М. этого типа предназначены для исследования громоздких объектов, которые трудно или невозможно расположить на предметных столиках обычных М. В биологии с помощью таких М. изучают находящиеся в питательной среде Культуры тканей, которые помещают в термостатирующую камеру для поддержания заданной температуры. Инвертированные М. применяют также для исследования химических реакций, определения точек плавления материалов и в других случаях, когда для осуществления наблюдаемых процессов требуется громоздкое вспомогательное оборудование. Для микрофотографирования и микрокиносъёмки инвертированные М. снабжают специальными устройствами и камерами.
Особенно удобна схема инвертированного М. для наблюдения в отражённом свете структур различных поверхностей. Поэтому она применяется в большинстве металлографических М. В них образец (шлиф металла, сплава или минерала) устанавливается на столике полированной поверхностью вниз, а остальная его часть может иметь произвольную форму и не требует какой-либо обработки. Существуют также металлографические М., в которых объект располагают снизу, закрепляя его на специальной пластине; взаимное положение узлов в таких М. то же, что и в обычных (неинвертированных) М. Изучаемая поверхность часто предварительно протравливается, благодаря чему зёрна её структуры становятся резко отличимыми друг от друга. В М. этого типа можно использовать метод светлого поля при прямом и косом освещении, метод тёмного поля и наблюдение в поляризованном свете. При работе в светлом поле объектив одновременно служит и конденсором. Для темнопольного освещения применяются зеркальные параболические эпиконденсоры. Введение специального вспомогательного устройства позволяет осуществить фазовый контраст в металлографических М. с обычным объективом (рис. 9 ).
Люминесцентные М. оснащаются набором сменных светофильтров, подбирая которые можно выделить в излучении осветителя часть спектра, возбуждающую люминесценцию конкретного исследуемого объекта. Подбирается также светофильтр, пропускающий от объекта только свет люминесценции. Свечение многих объектов возбуждается УФ лучами или коротковолновой частью видимого спектра; поэтому источниками света в люминесцентных М. служат дающие именно такое (и очень яркое) излучение ртутные лампы сверхвысокого давления (см. Газоразрядные источники света). Помимо специальных моделей люминесцентных М., имеются люминесцентные устройства, используемые совместно с обычными М.; они содержат осветитель с ртутной лампой, набор светофильтров и т. н. опак-иллюминатор для освещения препаратов сверху.
Ультрафиолетовые и инфракрасные М. служат для исследований в невидимых для глаза областях спектра. Их принципиальные оптические схемы аналогичны схеме обычных М. Из-за большой сложности исправления аберраций в УФ и ИК областях конденсор и объектив в таких М. часто представляют собой Зеркально-линзовые системы, в которых существенно уменьшается или полностью отсутствует хроматическая аберрация. Линзы изготовляются из материалов, прозрачных для УФ (кварц, флюорит) или ИК (кремний, германий, флюорит, фтористый литий) излучения. Ультрафиолетовые и инфракрасные М. снабжены фотокамерами, в которых фиксируется невидимое изображение; визуальное наблюдение через окуляр в обычном (видимом) свете служит, когда это возможно, лишь для предварительной фокусировки и ориентировки объекта в поле зрения М. Как правило, в этих М. имеются электроннооптические преобразователи, превращающие невидимое изображение в видимое.
Поляризационные М. предназначены для изучения (с помощью оптических компенсаторов) изменений в поляризации света, прошедшего через объект или отражённого от него, что открывает возможности количественного или полуколичественного определения различных характеристик оптически активных объектов. Узлы таких М. обычно выполняются так, чтобы облегчить точные измерения: окуляры снабжаются перекрестием, микрометрической шкалой или сеткой; вращающийся предметный столик -- угломерным лимбом для измерения угла поворота; часто на предметном столике крепится Федорова столик (см. Фёдорова столик), дающий возможность произвольно поворачивать и наклонять препарат для нахождения кристаллографических и кристаллооптических осей. Объективы поляризационных М. специально подбираются так, чтобы в их линзах отсутствовали внутренние напряжения, приводящие к деполяризации света. В М. этого типа обычно имеется включаемая и выключаемая вспомогательная линза (т. н. линза Бертрана), используемая при наблюдениях в проходящем свете; она позволяет рассматривать интерференционные фигуры (см. Кристаллооптика), образуемые светом в задней фокальной плоскости объектива после прохождения через исследуемый кристалл.
С помощью интерференционных М. наблюдают прозрачные объекты по методу интерференционного контраста; многие из них конструктивно аналогичны обычным М., отличаясь лишь наличием специального конденсора, объектива и измерительного узла. Если наблюдение производится в поляризованном свете, то такие М. снабжаются поляризатором и анализатором. По области применения (главным образом биологические исследования) эти М. можно отнести к специализированным биологическим М. К интерференционным М. часто относят также Микроинтерферометры -- М. особого типа, применяемые для изучения микрорельефа поверхностей обработанных металлических деталей.
Стереомикроскопы. Бинокулярные тубусы, используемые в обычных М., при всём удобстве наблюдения двумя глазами не дают стереоскопического эффекта: в оба глаза попадают в этом случае под одинаковыми углами одни и те же лучи, лишь разделяемые на два пучка призменной системой. Стереомикроскопы, обеспечивающие подлинно объёмное восприятие микрообъекта, представляют собой фактически два М., выполненных в виде единой конструкции так, что правый и левый глаза наблюдают объект под разными углами (рис. 10 ). Наиболее широкое применение такие М. находят там, где требуется производить какие-либо операции с объектом в ходе наблюдения (биологического исследования, хирургической операции на сосудах, мозге, в глазу -- Микрургия, сборка миниатюрных устройств, например Транзисторов), -- стереоскопическое восприятие облегчает эти операции. Удобству ориентировки в поле зрения М. служит и включение в его оптическую схему призм, играющих роль оборачивающих систем (см. Оборачивающая система); изображение в таких М. прямое, а не перевёрнутое. Так как угол между оптическими осями объективов в стереомикроскопах обычно? 12°, их числовая апертура, как правило, не превышает 0,12. Поэтому и полезное увеличение таких М. бывает не более 120.
М. сравнения состоят из двух конструктивно объединённых обычных М. с единой окулярной системой. Наблюдатель видит в двух половинах поля зрения такого М. изображения сразу двух объектов, что позволяет непосредственно сравнить их по цвету, структуре и распределению элементов и другим характеристикам. М. сравнения широко применяются при оценке качества обработки поверхностей, определении сортности (сравнение с эталонным образцом) и т. д. Специальные М. такого типа используют в криминологии, в частности для идентификации оружия, из которого выпущена исследуемая пуля.
В телевизионных М., работающих по схеме микропроекции, изображение препарата преобразуется в последовательность электрических сигналов, которые затем воспроизводят это изображение в увеличенном масштабе на экране электроннолучевой трубки (см. Электроннолучевая трубка) (кинескопа). В таких М. можно чисто электронным путём, изменяя параметры электрической цепи, по которой проходят сигналы, менять контраст изображения и регулировать его яркость. Электрическре усиление сигналов позволяет проектировать изображения на большой экран, в то время как обычная микропроекция требует для этого чрезвычайно сильного освещения, часто вредного для микроскопических объектов. Большое достоинство телевизионных М. заключается в том, что с их помощью можно дистанционно изучать объекты, близость к которым опасна для наблюдателя (например, радиоактивные).
При многих исследованиях необходимо вести счёт микроскопических частиц (например, бактерий в колониях, аэрозолей, частиц в коллоидных растворах, клеток крови и т. д.), определять площади, занимаемые зёрнами одного и того же рода в шлифах сплава, и производить др. аналогичные измерения. Преобразование изображения в телевизионных М. в серию электрических сигналов (импульсов) дало возможность построить автоматические счётчики микрочастиц, регистрирующие их по числу импульсов.
Назначение измерительных М. состоит в точном измерении линейных и угловых размеров объектов (зачастую совсем не малых). По способу измерения их можно разделить на два типа. Измерительные М. 1-го типа применяются только в тех случаях, когда измеряемое расстояние не превышает линейных размеров поля зрения М. В таких М. непосредственно (с помощью шкалы или винтового окулярного микрометра (см.Окулярный микрометр)) измеряется не сам объект, а его изображение в фокальной плоскости окуляра, и лишь затем, по известному значению увеличения объектива, вычисляется измеренное расстояние на объекте. Часто в этих М. изображения объектов сравниваются с образцовыми профилями, нанесёнными на пластинки сменных окулярных головок. В измерительныхМ. 2-го типа предметный столик с объектом и корпус М. можно с помощью точных механизмов перемещать друг относительно друга (чаще -- столик относительно корпуса); измеряя это перемещение микрометрическим винтом или шкалой, жестко скрепленной с предметным столиком, определяют расстояние между наблюдаемыми элементами объекта. Существуют измерительные М., у которых измерение производится лишь в одном направлении (однокоординатные М.). Гораздо более распространены М. с перемещениями предметного столика в двух перпендикулярных направлениях (пределы перемещений до 200Ч500 мм); для специальных целей применяются М., в которых измерения (а следовательно, и относительные перемещения столика и корпуса М.) возможны в трёх направлениях, соответствующих трём осям прямоугольных координат. На некоторых М. можно проводить измерения в полярных координатах; для этого предметный столик делают вращающимся и снабжают шкалой и Нониусом для отсчёта углов поворота. В наиболее точных измерительных М. 2-го типа употребляются стеклянные шкалы, а отсчёты на них осуществляются с помощью вспомогательного (т. н. отсчётного) микроскопа (см. ниже). Точность измерений в М. 2-го типа значительно выше по сравнению с М. 1-го типа. В лучших моделях точность линейных измерений обычно порядка 0,001 мм, точность измерения углов -- порядка 1". Измерительные М. 2-го типа широко применяются в промышленности (особенно в машиностроении) для измерения и контроля размеров деталей машин, инструментов и пр.
В устройствах для особо точных измерений (например, геодезических, астрономических и т. д.) отсчёты на линейных шкалах и разделённых кругах угломерных инструментов производят с помощью специальныхотсчётных М. -- шкаловых М. и М.-микрометров. В первых имеется вспомогательная стеклянная шкала. Её изображение регулировкой увеличения объектива М. делают равным наблюдаемому интервалу между делениями основной шкалы (или круга), после чего, отсчитывая положение наблюдаемого деления между штрихами вспомогательной шкалы, можно непосредственно определить его с точностью около 0,01 интервала между делениями. Ещё выше точность отсчётов (порядка 0,0001 мм) в М.-микрометрах, в окулярной части которых помещен нитяной или спиральный микрометр. Увеличение объектива регулируют так, чтобы перемещению нити между изображениями штрихов измеряемой шкалы соответствовало целое число оборотов (или полуоборотов) винта микрометра.
Помимо описанных выше, имеется значительное число ещё более узко специализированных типов М., например М. для подсчёта и анализа следов элементарных частиц и осколков деления ядер в ядерных фотографических эмульсиях (см. Ядерная фотографическая эмульсия), высокотемпературные М. для изучения объектов, нагретых до температуры порядка 2000 °С, контактные М. для исследования поверхностей живых органов животных и человека (объектив в них прижимается вплотную к изучаемой поверхности, а фокусировка М. производится специальной встроенной системой).
Заключение
Чего же можно ждать от микроскопии завтрашнего дня? На решение каких задач можно рассчитывать? Прежде всего - распространение на все новые и новые объекты. Достижение атомарного разрешения, безусловно, является крупнейшим завоеванием научной и технической мысли. Однако не будем забывать, что это достижение распространяется лишь на ограниченный круг объектов, помещенных к тому же в весьма специфические, необычные и сильно воздействующие условия. Поэтому необходимо стремиться распространить атомарное разрешение на широкий круг объектов.
Со временем можно ожидать привлечения «на работу» в микроскопах другие заряженные частицы. Ясно, однако, что этому должны предшествовать поиски и разработка мощных источников таких частиц; кроме того, создание микроскопов нового типа будет определяться появлением конкретных научных задач, в решение которых именно эти новые частицы внесут решающий вклад.
Будут совершенствоваться микроскопические исследования процессов в динамике, т.е. происходящих непосредственно в микроскопе или в сочлененных с ним установках. К таким процессам относятся испытания образцов в микроскопе (нагрев, растяжение и т.д.) непосредственно во время анализа их микроструктуры. Здесь успех будет обусловлен, в первую очередь, развитием техники высокоскоростной фотографии и повышением временного разрешения детекторов (экранов) микроскопов, а также использованием мощных современных компьютеров.
Список использованной литературы
1. Малая медицинская энциклопедия. -- М.: Медицинская энциклопедия. 1991--96 гг.
2. Первая медицинская помощь. -- М.: Большая Российская Энциклопедия. 1994 г.
3. Энциклопедический словарь медицинских терминов. -- М.: Советская энциклопедия. -- 1982--1984 гг.
4. http://dic.academic.ru/
5. http://ru.wikipedia.org/
6. www.golkom.ru
7. www.avicenna.ru
8. www.bionet.nsc.ru
Размещено на Allbest.ru
...Подобные документы
Характеристика лабораторной диагностики вирусных инфекций при помощи электронной микроскопии. Подготовка срезов пораженной ткани к исследованию. Описание метода иммуноэлектронной микроскопии. Иммунологические методы исследования, описание хода анализа.
курсовая работа , добавлен 30.08.2009
Эналаприл: основные свойства и механизм получения. Инфракрасная спектроскопия как метод идентификации эналаприла. Методы испытания на чистоту данного лекарственного вещества. Фармакодинамика, фаармакокинетика, применение, и побочные эффекты эналаприла.
реферат , добавлен 13.11.2012
Методы исследования головного мозга: электроэнцефалографические, неврологические, рентгенологические и ультразвуковые. Современные методы визуализации: компьютерная томография, магниро-резонансная томография, вентрикулоскопия, стереоскопическая биопсия.
презентация , добавлен 05.04.2015
Понятие антропометрии, её признаки, методики и развитие как науки, принципы антропометрических исследований. Телосложение человека и его виды. Основные типы пропорций тела. Генетические условия соматической конституции. Типология человека по Э. Кречмеру.
презентация , добавлен 30.05.2012
Требования к шовному материалу. Классификация шовного материала. Типы хирургических игл. Узлы в хирургии. Внутрикожные швы Холстеда и Холстеда-Золтона. Шов Апоневроза. Однорядные, двухрядные и трехрядные швы. Основные разновидности сосудистых швов.
презентация , добавлен 20.12.2014
Характеристика вида Origanum vulgare L. Степень химической изученности душицы обыкновенной и ее биологически активные соединения. Требования нормативной документации на сырье. Методы микроскопических исследований. Качественные реакции на кумарины.
курсовая работа , добавлен 11.05.2014
Сущность и отличительные особенности статистического исследования, требования к нему, используемые методы и приемы. Интерпретация и оценка полученных результатов. Типы наблюдений и принципы их реализации. Классификация опросов и анализ их эффективности.
презентация , добавлен 18.12.2014
Понятие инфектологии и инфекционного процесса. Основные признаки, формы и источники инфекционных болезней. Виды болезнетворных микроорганизмов. Периоды инфекционной болезни у человека. Методы микробиологических исследований. Методы окраски мазков.
презентация , добавлен 25.12.2011
Естественные методы контрацепции. Метод лактационной аменореи как вид контрацепции. Современные спермициды, их преимущества и принцип действия. Барьерные методы: презервативы. Гормональные виды контрацепции. Механизм действия оральных контрацептивов.
презентация , добавлен 17.10.2016
Шок - неспецифический фазово-протекающий клинический синдром, характеризующийся общим тяжелым состоянием организма: патологическая классификация, стадии, виды и характеристика гемодинамики. Стандартный мониторинг при шоке, лечение, показания к операциям.
Микроскопические методы исследования представляют собой способы изучения разнообразных объектов с использованием специального оборудования. Оно позволяет рассматривать строение веществ и организмов, величина которых находится за границами разрешающей способности человеческого взгляда. В статье проведем краткий анализ микроскопических методов исследования.
Общие сведения
Современные методы микроскопического исследования используют в своей практике разные специалисты. Среди них вирусологи, цитологи, гематологи, морфологи и прочие. Основные методы известны достаточно давно. В первую очередь это световой способ рассмотрения объектов. В течение последних лет активно вводятся в практику и другие технологии. Так, популярность приобрели фазово-контрастный, люминесцентный, интерференционный, поляризационный, инфракрасный, ультрафиолетовый, стереоскопический метод исследования . Все они базируются на разнообразных свойствах света. Кроме этого, широко используются электронно-микроскопические методы исследования . Эти способы позволяют отобразить объекты с помощью направленного потока заряженных частиц. Стоит отметить, что такие приемы изучения применяются не только в биологии и медицине. Достаточно популярен в промышленности. Такое изучение позволяет оценивать поведение соединений, вырабатывать технологии для минимизации вероятности разрушения и усиления прочности.
Световые способы: характеристика
Такие микроскопические методы исследования микроорганизмов и других объектов базируются на различной оборудования. Немаловажными факторами при этом является направленность луча, особенности самого объекта. Последний, в частности, может быть прозрачным или непрозрачным. В соответствии со свойствами объекта, меняются физические свойства светового потока - яркость и цвет, обусловленные амплитудой и длиной волны, плоскость, фаза и направленность распространения волны. На использовании этих характеристик и строятся разные .
Специфика
Для изучения световыми способами объекты, как правило, окрашивают. Это позволяет выявить и описать те или иные их свойства. При этом необходимо, чтобы ткани были фиксированными, поскольку окраска выявит определенные структуры исключительно в убитых клетках. В живых элементах краситель обосабливается в виде вакуоли в цитоплазме. Она не прокрашивает структуры. Но с помощью светового микроскопа можно исследовать и живые объекты. Для этого используется витальный способ изучения. В таких случаях применяется темнопольный конденсор. Он встраивается в световой микроскоп.

Изучение неокрашенных объектов
Оно осуществляется с помощью фазово-контрастной микроскопии. Этот способ базируется на дифракции луча в соответствии с особенностями объекта. В процессе воздействия отмечается изменение фазы и длины волны. В объективе микроскопа присутствует полупрозрачная пластинка. Живые или фиксированные, но не окрашенные объекты из-за своей прозрачности почти не изменяют цвет и амплитуду луча, проходящего сквозь них, провоцируя только сдвиг волновой фазы. Но при этом, пройдя через объект, световой поток отклоняется от пластинки. В итоге между лучами, пропущенными сквозь объект, и входящими в световой фон, появляется разность волновой длины. При определенном ее значении возникает визуальный эффект - темный объект будет четко виден на светлом фоне либо наоборот (в соответствии с особенностями фазовой пластинки). Для его получения разность должна составлять не меньше 1/4 длины волны.
Аноптральный способ
Интерференционные приемы
Эти решают в целом те же задачи, что и фазово-контрастные. Однако в последнем случае специалисты могут наблюдать только контуры объектов. Интерференционные микроскопические методы исследования позволяют изучать их части, выполнять количественную оценку элементов. Это возможно благодаря раздвоению светового луча. Один поток проходит сквозь частицу объекта, а другой - мимо. В окуляре микроскопа они сходятся и интерферируют. Возникающая разность фаз может определяться по массе разных клеточных структур. При последовательном ее измерении с заданными можно установить толщину нефиксированных тканей и живых объектов, содержание белков в них, концентрацию сухого вещества и воды и пр. В соответствии с полученными данными специалисты получают возможность косвенно оценивать проницаемость мембран, активность ферментов, клеточный метаболизм.

Поляризация
Она осуществляется с помощью призм Николя или пленчатых поляроидов. Их помещают между препаратом и источником света. Поляризационный микроскопический метод исследования в микробиологии позволяет изучать объекты с неоднородными свойствами. В изотропных структурах быстрота распространения света не зависит от выбранной плоскости. При этом в анизотропных системах скорость изменяется в соответствии с направленностью света по поперечной либо продольной оси объекта. В случае если величина преломления вдоль структуры будет больше, чем вдоль поперечной, создается двойное положительное лучепреломление. Это свойственно многим биологическим объектам, у которых обнаруживается строгая молекулярная ориентация. Они все являются анизотропными. К этой категории, в частности, относятся миофибриллы, нейрофибриллы, реснички в мерцательном эпителии, коллагеновые волокна и прочие.
Значение поляризации
Сравнение характера лучевого преломления и показателя анизотропии объекта дает возможность оценивать молекулярную организацию структуры. Поляризационный метод выступает как один из гистологических способов анализа, используется в цитологии и пр. В свете можно изучать не только окрашенные объекты. Поляризационный метод дает возможность исследовать неокрашенные и нефиксированные - нативные - препараты тканевых срезов.

Люминесцентные приемы
Они базируются на свойствах некоторых объектов давать свечение в сине-фиолетовом участке спектра или в УФ-лучах. Многие вещества, например белки, некоторые витамины, коферменты, лекарственные средства, наделены первичной (собственной) люминесценцией. Другие объекты начинают светиться при добавлении флюорохромов - специальных красителей. Эти добавки избирательно или диффузно распространяются на отдельные клеточные структуры или химические соединения. Это свойство легло в основу использования люминесцентной микроскопии при гистохимических и
Области использования
Применяя иммуно-флуоресценцию, специалисты обнаруживают вирусные антигены и устанавливают их концентрацию, идентифицируют вирусы, анти тела и антигены, гормоны, разнообразные продукты метаболизма и так далее. В этой связи при диагностике герпеса, эпидемического паротита, вирусного гепатита, гриппа и прочих инфекций используются люминесцентные методы исследования материалов. Микроскопический иммуно-флуоресцентный способ позволяет распознавать опухоли злокачественного характера, определять ишемические участки в сердце на ранних этапах инфаркта и пр.

Использование ультрафиолета
Оно основывается на способности ряда веществ, включенных в живые клетки, микроорганизмы или фиксированные, но неокрашенные, прозрачные при видимом свете ткани поглощать УФ-лучи определенной длины волн. Это характерно, в частности, для высокомолекулярных соединений. К ним относят белки, ароматические кислоты (метилаланин, триптофан, тирозин и пр.), нуклеиновые кислоты, пирамидиновые и пуриновые основания и так далее. Ультрафиолетовая микроскопия позволяет уточнить локализацию и количество этих соединений. При изучении живых объектов специалисты могут наблюдать изменения процессов их жизнедеятельности.

Дополнительно
Инфракрасная микроскопия используется при исследовании непрозрачных для света и УФ-лучей объектов посредством поглощения их структурами потока, длина волны которого 750-1200 нм. Чтобы применить этот способ нет необходимости предварительно подвергать препараты химической обработке. Как правило, инфракрасный метод используется в антропологии, зоологии и прочих биологических отраслях. Что касается медицины, то этот способ применяют преимущественно в офтальмологии и нейроморфологии. Изучение объемных объектов осуществляется с помощью стереоскопической микроскопии. Конструкция оборудования позволяет выполнять наблюдение левым и правым глазом под различным углом. Непрозрачные объекты исследуются при сравнительно небольшом увеличении (не более 120 раз). Стереоскопические способы используются в микрохирургии, патоморфологии, в судебной медицине.
Электронная микроскопия
Она используется для изучения структуры клеток и тканей на макромолекулярном и субклеточном уровнях. позволила сделать качественный скачок в сфере исследований. Этот способ широко применяется в биохимии, онкологии, вирусологии, морфологии, иммунологии, генетике и прочих отраслях. Значительное усиление разрешающей способности оборудования обеспечивается потоком электронов, которые проходят в вакууме сквозь электромагнитные поля. Последние, в свою очередь, создаются специальными линзами. Электроны обладают способностью проходить сквозь структуры объекта либо отражаться от них с отклонениями под разными углами. В результате создается отображение на люминесцентном экране прибора. При просвечивающей микроскопии получается плоскостное изображение, при сканирующей, соответственно, объемное.

Необходимые условия
Стоит отметить, что перед тем, как пройти электронное микроскопическое исследование, объект подвергается специальной подготовке. В частности, используется физическая либо химическая фиксация тканей и организмов. Секционный и биопсийный материал, кроме этого, обезвоживают, внедряют в эпоксидные смолы, разрезают алмазными или стеклянными ножами на ультратонкие срезы. Затем их контрастируют и изучают. В сканирующем микроскопе исследуются поверхности объектов. Для этого на них напыляют специальные вещества в вакуумной камере.
Для обнаружения и исследования микроорганизмов применяют микроскопы. Световые
микроскопы предназначены для изучения микроорганизмов, которые имеют размеры
не менее 0,2 мкм (бактерии, простейшие и т. п.) a электронные для изучения
более мелких микроорганизмов (вирусы) и мельчайших структур бактерий.
Современные световые микроскопы
- это сложные оптические
приборы, обращение с которыми требует определенных знаний, навыков и большой
аккуратности.
Световые микроскопы подразделяются на студенческие, рабочие, лабораторные
и исследовательские, различающиеся по конструкции и комплектации оптикой.
Отечественные микроскопы (Биолам", "Бимам", "Микмед")
имеют обозначения, указывающие, к какой группе они относятся (С - студенческие,
Р - рабочие, Л - лабораторные, И - исследовательские), комплектация обозначается
цифрой.
В микроскопе различают механическую и оптическую части.
К механической части
относятся: штатив (состоящий из основания
и тубусодержателя) и укрепленные на нем тубус с револьвером для крепления
и смены объективов, предметный столик для препарата, приспособления для крепления
конденсора и светофильтров, а также встроенные в штатив механизмы для грубого
(макромеханизм, макровинт) и тонкого
(микромеханизм, микровинт) перемещения предметного столика или тубусодержателя.
Оптическая часть
микроскопа представлена объективами, окулярами
и осветительной системой, которая в свою очередь состоит из расположенных
под предметным столиком конденсора Аббе, зеркала, имеющего плоскую и вогнутую
сторону, а также отдельного или встроенного осветителя. Объективы ввинчиваются
в револьвер, а соответствующий окуляр, через который наблюдают изображение,
устанавливают с противоположной стороны тубуса. Различают монокулярный (имеющий
один окуляр) и бинокулярный (имеющий два одинаковых окуляра) тубусы.
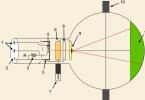
Принципиальная схема микроскопа и осветительной системы
 1.
Источник света;
1.
Источник света;
2. Коллектор;
3. Ирисовая полевая диафрагма;
4. Зеркало;
5. Ирисовая аппертурная диафрагма;
6. Конденбсор;
7. Препарат;
7". Увеличенное действительное промежуточное изображение препарата, образуемое; объективом;
7"". Увеличенное мнимое окончательное изображение препарата, наблюдаемое в
окуляре;
8. Объектив;
9. выходной значок объектива;
10. Полевая диафрагма окуляра;
11. Окуляр;
12. Глаз.
Основную роль в получении изображения играет объектив
. Он
строит увеличенное, действительное и перевернутое изображение объекта. Затем
это изображение дополнительно увеличивается при рассматривании его через окуляр,
который аналогично обычной лупе дает увеличенное мнимое изображение.
Увеличение
микроскопа ориентировочно можно определить, умножая
увеличение объектива на увеличение окуляра. Однако увеличение не определяет
качества изображения. Качество изображения, его четкость, определяется разрешающей
способностью микроскопа
, т. е. возможностью различать раздельно две
близко расположенные точки. Предел разрешения
- минимальное
расстояние, на котором эти точки еще видны раздельно,- зависит от длины волны
света, которым освещается объект, и числовой апертуры объектива. Числовая
апертура, в свою очередь, зависит от угловой апертуры объектива и показателя
преломления среды, находящейся между фронтальной линзой объектива и препаратом.
Угловая апертура-это максимальный угол, под которым могут попадать в объектив
лучи, прошедшие через объект. Чем больше апертура и чем ближе показатель преломления
среды, находящейся между объективом и препаратом, к показателю преломления
стекла, тем выше разрешающая способность объектива. Если считать апертуру
конденсора равной апертуре объектива, то формула разрешающей способности имеет
следующий вид:
где R - предел разрешения; - длина волны; NA - числовая апертура.
Различают полезное
и бесполезное
увеличение. Полезное увеличение обычно равно числовой апертуре объектива,
увеличенной в 500-1000 раз. Более высокое окулярное увеличение не выявляет
новых деталей и является бесполезным.
В зависимости от среды, которая находится между объективом и препаратом, различают
«сухие» объективы малого и среднего увеличения (до 40 х) и иммерсионные с
максимальной апертурой и увеличением (90-100 х). «Сухой» объектив - это такой
объектив, между фронтальной линзой которого и препаратом, находится воздух.

Особенностью иммерсионных объективов является то, что между
фронтальной линзой такого объектива и препаратом помещают иммерсионную жидкость,
имеющую показатель преломления такой же, как стекло (или близкий к нему),
что обеспечивает увеличение числовой апертуры и разрешающей способности объектива.
В качестве иммерсионной жидкости для объективов водной иммерсии используют
дистиллированную воду, а для объективов масляной иммерсии-кедровое масло или
специальное синтетическое иммерсионное масло. Использование синтетического
иммерсионного масла предпочтительнее, поскольку его параметры более точно
нормируются, и оно в отличие от кедрового, не засыхает на поверхности фронтальной
линзы объектива. Для объективов, работающих в ультрафиолетовой области спектра,
в качестве иммерсионной жидкости используют глицерин. Ни в коем случае нельзя
пользоваться суррогатами иммерсионного масла и, в частности, вазелиновым маслом.
**Изображение, полученное с помощью линз, обладает различными недостатками:
сферической и хроматической аберрациями, кривизной поля изображения и др.
В объективах, состоящих из нескольких линз, эти недостатки в той или иной
мере исправлены. В зависимости от степени исправления этих недостатков различают
объективы ахроматы и более сложные апохроматы. Соответственно объективы, в
которых исправлена кривизна поля изображения, называются планахроматами и
планапохроматами. Использование этих объективов позволяет получить резкое
изображение по всему полю, тогда как изображение, полученное с помощью обычных
объективов, не имеет одинаковой резкости в центре и на краях поля зрения.
Все характеристики объектива обычно выгравированы на его оправе: собственное
увеличение, апертура, тип объектива (АПО - апохромат и т. п.); объективы водной
иммерсии имеют обозначение ВИ и белое кольцо вокруг оправы в нижней ее части,
объективы масляной иммерсии-обозначение МИ и черное кольцо.
Все объективы рассчитаны для работы с покровным стеклом толщиной 0,17мм.
Толщина покровного стекла особенно влияет на качество изображения при работе
с сильными сухими системами (40 х). При работе с иммерсионными объективами
нельзя пользоваться покровными стеклами толще 0,17 мм потому, что толщина
покровного стекла может оказаться больше, чем рабочее расстояние объектива,
и в этом случае, при попытке сфокусировать объектив на препарат, может быть
повреждена фронтальная линза объектива.
Окуляры состоят из двух линз и тоже бывают нескольких типов, каждый из которых
применяется с определенным типом объектива, дополнительно устраняя недостатки
изображения. Тип окуляра и его увеличение обозначены на его оправе.
Конденсор предназначен для того, чтобы сфокусировать на препарате свет от
осветителя, направляемый зеркалом микроскопа или осветителя (в случае использования
накладного или встроенного осветителя). Одной из деталей конденсора является
апертурная диафрагма, которая имеет важное значения для правильного освещения
препарата.
Осветитель состоит из низковольтной лампы накаливания с толстой нитью, трансформатора,
коллекторной линзы и полевой диафрагмы, от раскрытия, которой зависит диаметр
освещенного поля на препарате. Зеркало направляет свет от осветителя в конденсор.
Для того чтобы сохранить параллельность лучей, идущих от осветителя в конденсор,
необходимо использовать только плоскую сторону зеркала.
Настройка освещения н фокусировка микроскопа
Качество изображения в значительной мере зависит также от
правильного освещения. Существует несколько различных способов освещения препарата
при микроскопии. Наиболее распространенным является способ установки
света по Келеру
, который заключается в следующем:
1) устанавливают осветитель против зеркала микроскопа;
2) включают лампу осветителя и направляют свет на плоское (!) зеркало микроскопа;
3)помещают препарат на предметный столик микроскопа;
4) закрывают зеркало микроскопа листком белой бумаги и фокусируют на нем изображение
нити лампы, передвигая патрон лампы в осветителе;
5) убирают лист бумаги с зеркала;
6) закрывают апертурную диафрагму конденсора. Перемещая зеркало и слегка передвигая
патрон лампы, фокусируют изображение нити на апертурной диафрагме. Расстояние
осветителя от микроскопа должно быть таким, чтобы изображение нити лампы было
равно диаметру апертурной диафрагмы конденсора (наблюдать апертурную диафрагму
можно с помощью плоского зеркала, помещенного с правой стороны основания микроскопа).
7)открывают апертурную диафрагму конденсора, уменьшают отверстие полевой диафрагмы
осветителя и значительно уменьшают накал лампы;
8) при малом увеличении (10х), глядя в окуляр, получают резкое изображение
препарата;
9)слегка поворачивая зеркало, переводят изображение полевой диафрагмы, которое
имеет вид светлого пятна, в центр поля зрения. Опуская и поднимая конденсор,
добиваются получения резкого изображения краев полевой диафрагмы в плоскости
препарата (вокруг них может быть видна цветная каемка);
10) раскрывают полевую диафрагму осветителя до краев поля зрения, увеличивают
накал нити лампы и слегка (на 1/3) уменьшают раскрытие апертурной диафрагмы
конденсора;
11)при смене объектива необходимо проверить настройку света.
После окончания настройки света по Келеру нельзя изменять положение конденсораf
раскрытие полевой и апертурной диафрагмы. Освещенность препарата можно регулировать
только нейтральными светофильтрами или изменением накала лампы с помощью реостата.
Излишнее открытие апертурной диафрагмы конденсора может привести к значительному
снижению контраста изображения, а недостаточное - к значительному ухудшению
качества изображения (появлению диффракционных колец). Для проверки правильности
раскрытия апертурной диафрагмы необходимо удалить окуляр и, глядя в тубус,
открыть ее таким образом, чтобы она закрывала светящееся поле на одну треть.
Для правильного освещения препарата при работе с объективами малого увеличения
(до 10х) необходимо отвинтить и снять верхнюю линзу конденсора.
Внимание! При работе с объективами, дающими большое увеличение - с сильными
сухими (40х) и иммерсионными (90х) системами, чтобы не повредить фронтальную
линзу, при фокусировке пользуются следующим приемом: наблюдая сбоку, опускают
объектив макровинтом почти до соприкосновения с препаратом, затем, глядя в
окуляр, макровинтом очень медленно поднимают объектив до появления изображения
и с помощью микровинта производят окончательную фокусировку микроскопа.
Уход за микроскопом
При работе с микроскопом нельзя применять большие усилия.
Нельзя касаться пальцами поверхности линз, зеркал и светофильтров.
Чтобы предохранить внутренние поверхности объективов, а также призмы тубуса
от попадания пыли, необходимо всегда оставлять окуляр в тубусе. При чистке
внешних поверхностей линз нужно удалить с них пыль мягкой кисточкой, промытой
в эфире. Если необходимо, осторожно протирают поверхности линз хорошо выстиранной,
не содержащей остатков мыла, полотняной или батистовой тряпочкой, слегка смоченной
чистым бензином, эфиром или специальной смесью для чистки оптики. Не рекомендуется
протирать оптику объективов ксилолом, так как это может привести к их расклеиванию.
С зеркал, имеющих наружное серебрение, можно только удалять пыль, сдувая ее
резиновой грушей. Протирать их нельзя. Нельзя также самостоятельно развинчивать
и разбирать объективы - это приведет к их порче. По окончании работы на микроскопе
необходимо тщательно удалить остатки иммерсионного масла с фронтальной линзы
объектива указанным выше способом. Затем опустить предметный столик (или конденсор
в микроскопах с неподвижным столиком) и накрыть микроскоп чехлом.
Для сохранения внешнего вида микроскопа необходимо периодически протирать
его мягкой тряпкой, слегка пропитанной бескислотным вазелином и затем сухой
мягкой чистой тряпкой.
Помимо обычной световой микроскопии существуют методы микроскопии, позволяющие изучать неокрашенные микроорганизмы: фазово-контрастная , темнопольная и люминесцентная микроскопия. Для изучения микроорганизмов и их структур, размер которых меньше разрешающей способности светового микроскопа используют
В данной статье мы ознакомимся широко развитой методикой исследования разнообразных микроэлементов нашего мира - микроскопией. Здесь мы рассмотрим описание микроскопа, его предназначение, устройство, правила работы и исторические факты.
Ознакомление с приборами микроскопии
Микроскоп - это механизм, предназначение которого заключается в получении увеличенного изображения какого-либо объекта, а также в измерении структурных деталей, которых невозможно наблюдать невооруженным глазом.
Изобретение и создание разнообразных видов микроскопов позволило создать микроскопию - технологический метод практической эксплуатации этих приборов.
Исторические сведения
Кем был создан первый микроскоп в истории человечества, определить довольно проблематично. Впервые такой механизм был изобретен на рубеже шестнадцатого и семнадцатого веков. Вероятным изобретателем считают Захария Янсена, голландского ученого.
Будучи еще ребенком, Янсен используя дюймовую трубочку, установил на двух ее краях по одной выпуклой линзе. Увиденное заставило изобретателя создать нечто новое и улучшить его. Возможно, это обусловило изобретение первого в мире микроскопа, что произошло приблизительно в 1590 году.
Однако еще в 1538 г. итальянец Дж. Фракасторо, работая врачом, выдвинул предположение о комбинировании двух линз с целью создания еще большего увеличения изображений. Следовательно, его работа могла стать началом для появления первого микроскопа. Хотя термин был введен гораздо позже.
Другим первооткрывателем считается Галилео Галилей. Услышав приблизительно в 1609 г. о появлении такого увеличительного устройства и разобравшись в общей идее его механизма, уже в 1612 г. итальянский физик создал собственное массовое изготовление микроскопов. Название этому прибору дал академический друг Галилея, Джованни Фабер в 1613.

Уже в шестидесятых годах XVII века были получены данные о применении микроскопа в научной исследовательской деятельности. Первый это сделал Роберт Гук, занимавшийся наблюдением за устройством разнообразных растений. Именно он в работе «микрография» сделал зарисовки увиденного в микроскоп изображения. Он установил, что растительные организмы строятся из клеток.
Разрешающие способности
Одним из параметров микроскопа является его разрешающая способность. Различные виды микроскопов имеют, соответственно, разный показатель этой характеристики. Так что же это такое?
Разрешающая способность - это возможности прибора показывать четкое и качественное изображение, картинку двух расположенных рядом, фрагментов исследуемого объекта. Показатель степени углубления в микромир и общая возможность его исследования базируются именно на этой способности. Данную характеристику определяет длина волны излучения, которую используют в микроскопе. Главным ограничением является невозможность получения картинки объекта, размеры которого меньше размера длины излучения.
Ввиду написанного выше становится очевидно, что благодаря разрешающей способности мы можем получать четкое изображение деталей изучаемого объекта.
Основные параметры
К другим важным параметрам в строении микроскопа относятся его увеличение, насадки, размер предметного столика, возможности подсветки, оптическое покрытие и т. д.
Рассмотрим главный из перечисленных в этом пункте показателей - увеличение.

Увеличение - это общая способность микроскопа показывать изучаемые объекты в больших размерах, чем они есть на самом деле. Вычисление этого параметра можно произвести путем умножения объективного увеличения на окулярное. Данная возможность в оптических микроскопах доходит до 2000 крат, а электронный имеет увеличение в сотни раз больше, чем световой.
Основная характеристика микроскопа - это именно его разрешающая способность, а также увеличение. Поэтому при выборе такого прибора на эти показатели необходимо обратить особое внимание.
Составные элементы
Микроскоп, как и любой другой механизм, состоит из определенных деталей, среди которых выделяют:
- предметный столик;
- рукоятку переключения;
- окуляр;
- тубус;
- держатель для тубуса;
- микрометренный винт;
- винт грубой наводки;
- зеркальце;
- подставку;
- объектив;
- стойку;
- бинокулярную насадку;
- оптическую головку;
- конденсор;
- светофильтр;
- ирисовую диафрагму.
Ознакомимся с основными характеристиками образующих структур микроскопа.
Объектив - является средством определения полезного увеличения. Образуется из определенного количества линз. Увеличительные возможности указываются цифрами на его поверхности.
Окуляр - состоящий из двух-трех линз элемент микроскопа, увеличение которого обозначается на нем цифрам. Общий показатель увеличительных способностей прибора определяется путем перемножения показателя увеличения объектива на увеличение окуляра.
Осветительные устройства включают в себя зеркальце или электроосветитель, конденсор и диафрагмой, светофильтр и столик.
Механическая система образуется подставкой, коробочкой с микрометренным механизмом и винтом, тубусодержателем, винтом грубой наводки, конденсором, винтом перемещения конденсора, револьвером и предметным столиком.
Оптическая микроскопия
Среди существующих видов микроскопов выделяют несколько основных групп, характеризующихся определенными особенностями устройства и предназначения.

Глаз человека - это своего рода естественная оптическая система с определенными параметрами, например, разрешением. Разрешение, в свою очередь, характеризуется наименьшим показателем разности в расстоянии между составными компонентами объекта, за которым наблюдают. Важнейшим пунктом здесь является наличие визуального отличия между наблюдаемыми фрагментами. Ввиду того, человеческий глаз не в силах наблюдать естественным путем за микроорганизмами, как раз и были созданы подобные увеличительные приборы.
Оптические микроскопы позволяли работать с излучением, лежащем в диапазоне от 400 до 700 нм и с ближним ультрафиолетом. Это длилось до середины двадцатого века. Подобные приборы не позволяли получать разрешающую способность меньшую, чем полупериод волны излучения опорного типа. Вследствие этого микроскоп позволял наблюдать за структурами, расстояние между которыми было около 0.20 мкм, из чего следует, что максимальное увеличение могло достигать 2000 крат.
Микроскопы бинокулярного типа
Бинокулярный микроскоп - это устройство, при помощи которого можно получить объемное увеличенное изображение. Другое название таких приборов - стереомикроскопы. Они позволяют человеку четко различать детали исследуемых объемных объектов.
В бинокулярном микроскопе рассмотрение объекта происходит сквозь две линзы, независимые между собой. В настоящее время используются сразу 2 окуляра и 1 объектов. Отлично работают в условиях наличия проходящего и отраженного света.
Электронная микроскопия
Появление электронного микроскопа позволило использовать электроны, обладающие свойствами и частиц, и волн в микроскопии.

Электрон обладает длинной волны, которая зависит от его энергетического потенциала: E = Ve, где V - величина разности потенциалов, e - электронный заряд. Длина волны электрона при пролете разности в потенциалах равной 200000 В составит около 0,1 нм. Электрон легко фокусируется при помощи электромагнитных линз, что обуславливается его зарядом. После электронную версию изображения переводят в видимую.
Среди таких увеличительных устройств набрал широкую известность цифровой микроскоп. Он позволяет подключать адаптеры к аппарату с целью переноса изображения на компьютер и его сохранения. При работе с подобными устройствами камера регистрирует наблюдаемое изображение, далее переносит его на ПК при помощи USB-кабеля.
Цифровой микроскоп может классифицироваться в соответствии с его режимом работы, увеличительной кратности, числу подсветок и разрешению камеры. Их главными достоинствами считаются наличие возможности переносить изображение на ПК и сохранять его, возможность в пересылке полученной информации на большие расстояния, редактирование, детальный анализ и хранение результатов исследования, а также умение проецировать картинку при помощи проекторов.
Электронные микроскопы обладают разрешающей способностью превосходящей световые в 1000-10000 раз.
Сканирующие зонды
Другой вид микроскопа - это сканирующий зонд. Сравнительно новая ветвь в развитии таких приборов.

Сокращенно их называют - ЗСМ. Изображение воспроизводится благодаря регистрации взаимодействия зонда и поверхности, которую он исследует. В современном мире такие механизмы позволяют наблюдать за взаимодействием зонда с атомами. Разрешающая способность ЗСМ сопоставима с микроскопами электронного типа, а в некоторых параметрах даже лучше.
Рентгеновская микроскопия
Рентгеновский микроскоп был создан для наблюдением за чрезвычайно малыми объектами, величина которых сопоставима с рентгеновскими волнами. Базируется на эксплуатации излучения электромагнитного характера, в котором длина волны не превышает один нанометр.

Разрешающая способность таких микроскопов заняла промежуточное место между оптическими и электронными. Теоретическая р.с. такого устройства может достигать 2-20 нм, что гораздо больше возможностей оптических микроскопов.
Общие сведения для работы с микроскопом
Эксплуатируя данный прибор необходимо знать правила работы с микроскопом:
- Работу необходимо выполнять сидя.
- Следует осмотреть прибор и протереть от пыли мягкими салфетками зеркальце, объектив и окуляр.
- При работе с микроскопом нежелательно его передвигать, поставить слева от себя.
- Произвести открытие диафрагмы, привести конденсор к верхнему положению.
- Работу стоит начинать с малого увеличения.
- Объектив довести до одного сантиметра от стекла с наблюдаемым объектом.
- Равномерно распределить освещение поля зрения, используя окуляр, в который необходимо смотреть глазом, и вогнутое зеркало.
- Переместить микропрепарат на столик микроскопа. Наблюдая сбоку, опустить объектив до уровня 4-5 мм над исследуемым объектом, используя для этого макровинт.
- Глядя глазом в окуляр, производить вращательные движения грубого винта, для подведения объектива к положению, в котором будет четко видно изображение.
- Перемещая стекло с препаратом, найдите место, где исследуемый объект будет располагаться по центру вашего поля зрения в микроскопе.
- В случае отсутствия изображения, повторите с шестого по девятый пункты.
- Используя микрометренный винт, добейтесь необходимой четкости изображения. Обратит внимание на то, не выходит ли точка между рисками на микрометренном механизме, за пределы рисок. Если выходит, то верните ее в стандартное положение.
- Заключаем правила работы с микроскопом, уборкой рабочего места. Необходимо вернуть увеличение с большого на малое, произвести поднятие объектива, снять препарат и протереть микроскоп, далее накрыть полиэтиленом и вернуть в шкафчик.
Данные правила в большей мере относятся к оптическим микроскопам. Строение микроскопа, например, электронного или рентгеновского, отличается от светового, а потому основные правила работы могут также отличаться. Особенности работы с такими устройствами можно найти в инструкции к ним.