Году. Опыт являлся одним из первых практических доказательств состоятельности молекулярно-кинетической теории строения вещества. В нём были непосредственно измерены скорости теплового движения молекул и подтверждено наличие распределения молекул газов по скоростям .
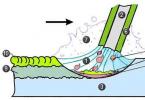
Для проведения опыта Штерном был подготовлен прибор, состоящий из двух цилиндров разного радиуса, ось которых совпадала и на ней располагалась платиновая проволока с нанесённым слоем серебра . В пространстве внутри цилиндров посредством непрерывной откачки воздуха поддерживалось достаточно низкое давление . При пропускании электрического тока через проволоку достигалась температура плавления серебра, из-за чего серебро начинало испаряться и атомы серебра летели к внутренней поверхности малого цилиндра равномерно и прямолинейно со скоростью v , определяемой температурой нагрева платиновой проволоки, т. е. температурой плавления серебра. Во внутреннем цилиндре была проделана узкая щель, через которую атомы могли беспрепятственно пролетать далее. Стенки цилиндров специально охлаждались, что способствовало оседанию попадающих на них атомов. В таком состоянии на внутренней поверхности большого цилиндра образовывалась достаточно чёткая узкая полоса серебряного налёта, расположенная прямо напротив щели малого цилиндра. Затем всю систему начинали вращать с некой достаточно большой угловой скоростью ω . При этом полоса налёта смещалась в сторону, противоположную направлению вращения, и теряла чёткость. Измерив смещение s наиболее тёмной части полосы от её положения, когда система покоилась, Штерн определил время полёта, через которое нашёл скорость движения молекул:
,
где s - смещение полосы, l - расстояние между цилиндрами, а u - скорость движения точек внешнего цилиндра.
Найденная таким образом скорость движения атомов серебра совпала со скоростью, рассчитанной по законам молекулярно-кинетической теории, а тот факт, что получившаяся полоска была размытой, свидетельствовал в пользу того, что скорости атомов различны и распределены по некоторому закону - закону распределения Максвелла : атомы, двигавшиеся быстрее, смещались относительно полосы, полученной в состоянии покоя, на меньшие расстояния, чем те, которые двигались медленнее.
Напишите отзыв о статье "Опыт Штерна"
Литература
- Краткий словарь физических терминов / Сост. А. И. Болсун, рец. М. А. Ельяшевич. - Мн. : Вышэйшая школа, 1979. - С. 388. - 416 с. - 30 000 экз.
Ссылки
- Ландсберг. Элементарный учебник физики. Том 1. Механика. Теплота. Молекулярная физика. - 12-е изд. - М .: ФИЗМАТЛИТ, 2001. - ISBN 5-9221-0135-8 .
- Интернет-школа Просвещение.ру. (рус.) (недоступная ссылка - история ) . Проверено 5 апреля 2008.
- Штерна опыт - статья из Большой советской энциклопедии .
Отрывок, характеризующий Опыт Штерна
Так он лежал и теперь на своей кровати, облокотив тяжелую, большую изуродованную голову на пухлую руку, и думал, открытым одним глазом присматриваясь к темноте.С тех пор как Бенигсен, переписывавшийся с государем и имевший более всех силы в штабе, избегал его, Кутузов был спокойнее в том отношении, что его с войсками не заставят опять участвовать в бесполезных наступательных действиях. Урок Тарутинского сражения и кануна его, болезненно памятный Кутузову, тоже должен был подействовать, думал он.
«Они должны понять, что мы только можем проиграть, действуя наступательно. Терпение и время, вот мои воины богатыри!» – думал Кутузов. Он знал, что не надо срывать яблоко, пока оно зелено. Оно само упадет, когда будет зрело, а сорвешь зелено, испортишь яблоко и дерево, и сам оскомину набьешь. Он, как опытный охотник, знал, что зверь ранен, ранен так, как только могла ранить вся русская сила, но смертельно или нет, это был еще не разъясненный вопрос. Теперь, по присылкам Лористона и Бертелеми и по донесениям партизанов, Кутузов почти знал, что он ранен смертельно. Но нужны были еще доказательства, надо было ждать.
«Им хочется бежать посмотреть, как они его убили. Подождите, увидите. Все маневры, все наступления! – думал он. – К чему? Все отличиться. Точно что то веселое есть в том, чтобы драться. Они точно дети, от которых не добьешься толку, как было дело, оттого что все хотят доказать, как они умеют драться. Да не в том теперь дело.
И какие искусные маневры предлагают мне все эти! Им кажется, что, когда они выдумали две три случайности (он вспомнил об общем плане из Петербурга), они выдумали их все. А им всем нет числа!»
Неразрешенный вопрос о том, смертельна или не смертельна ли была рана, нанесенная в Бородине, уже целый месяц висел над головой Кутузова. С одной стороны, французы заняли Москву. С другой стороны, несомненно всем существом своим Кутузов чувствовал, что тот страшный удар, в котором он вместе со всеми русскими людьми напряг все свои силы, должен был быть смертелен. Но во всяком случае нужны были доказательства, и он ждал их уже месяц, и чем дальше проходило время, тем нетерпеливее он становился. Лежа на своей постели в свои бессонные ночи, он делал то самое, что делала эта молодежь генералов, то самое, за что он упрекал их. Он придумывал все возможные случайности, в которых выразится эта верная, уже свершившаяся погибель Наполеона. Он придумывал эти случайности так же, как и молодежь, но только с той разницей, что он ничего не основывал на этих предположениях и что он видел их не две и три, а тысячи. Чем дальше он думал, тем больше их представлялось. Он придумывал всякого рода движения наполеоновской армии, всей или частей ее – к Петербургу, на него, в обход его, придумывал (чего он больше всего боялся) и ту случайность, что Наполеон станет бороться против него его же оружием, что он останется в Москве, выжидая его. Кутузов придумывал даже движение наполеоновской армии назад на Медынь и Юхнов, но одного, чего он не мог предвидеть, это того, что совершилось, того безумного, судорожного метания войска Наполеона в продолжение первых одиннадцати дней его выступления из Москвы, – метания, которое сделало возможным то, о чем все таки не смел еще тогда думать Кутузов: совершенное истребление французов. Донесения Дорохова о дивизии Брусье, известия от партизанов о бедствиях армии Наполеона, слухи о сборах к выступлению из Москвы – все подтверждало предположение, что французская армия разбита и сбирается бежать; но это были только предположения, казавшиеся важными для молодежи, но не для Кутузова. Он с своей шестидесятилетней опытностью знал, какой вес надо приписывать слухам, знал, как способны люди, желающие чего нибудь, группировать все известия так, что они как будто подтверждают желаемое, и знал, как в этом случае охотно упускают все противоречащее. И чем больше желал этого Кутузов, тем меньше он позволял себе этому верить. Вопрос этот занимал все его душевные силы. Все остальное было для него только привычным исполнением жизни. Таким привычным исполнением и подчинением жизни были его разговоры с штабными, письма к m me Stael, которые он писал из Тарутина, чтение романов, раздачи наград, переписка с Петербургом и т. п. Но погибель французов, предвиденная им одним, было его душевное, единственное желание.
Изучение диффузии и броуновского движения позволяет получить некоторое представление о скорости хаотического движения молекул газа. Одним из наиболее простых и наглядных опытов для ее определения является опыт О. Штерна, выполненный им в 1920 г. Сущность этого опыта заключается в следующем.
На горизонтальном столике, который может вращаться вокруг оси О (рис. 3.2), перпендикулярно столику укрепляются цилиндрические поверхности А и В. Поверхность В сплошная, а в поверхности А имеется узкий прорез, параллельный оси О. Вдоль оси О расположена вертикально платиновая посеребренная проволока, которая включается в электрическую цепь. При пропускании тока проволока накаливается и с ее поверхности происходит испарение серебра. Молекулы серебра летят во все стороны и в основном оседают на внутренней стороне цилиндрической поверхности А. Лишь узкий пучок молекул серебра пролетает сквозь щель в этой
поверхности и оседает в области М на поверхности В. Ширина налета в М определяется шириной щели в поверхности А. Чтобы молекулы серебра не рассеивались при столкновениях с молекулами воздуха, вся установка накрывается колпаком, из-под которого выкачивается воздух. Чем уже щель в поверхности А, тем уже налет в области М и тем точнее может быть определена скорость движения молекул.
Само определение скорости основано на следующей идее. Если всю установку привести во вращение вокруг оси О с постоянной угловой скоростью то за время в течение которого молекула будет лететь от щели до поверхности В, последняя успеет повернуться и налет сместится из области М в область К. Следовательно, время полета молекулы вдоль радиуса и время смещения точки М поверхности В на расстояние одинаково. Так как молекула летит равномерно, то
![]()
где - искомая скорость, - радиус цилиндрической поверхности А. Поскольку линейная скорость точек поверхности В равна юг, то время можно выразить другой формулой:
Таким образом,
![]()
Так как при выполнении опыта остаются постоянными и определяются заранее, то, измерив можно найти скорость молекулы . В опыте Штерна она оказалась близкой к 500 м/с.
Поскольку налет в области К оказывается размытым, можно заключить, что молекулы серебра летят к поверхности В с различной скоростью. Средние значения скоростей молекул математически можно выразить формулой

В качестве примера отметим, что при 0 °С средняя скорость движения молекул водорода равна 1840 м/с, а азота - 493 м/с. Изменение толщины налета в области К дает представление о распределении молекул по скоростям их движения. Получается, что небольшое число молекул имеет скорости, в несколько раз превышающие среднюю скорость.
(Подумайте, где на рис. 3.2 оставили след молекулы, скорости которых больше средней скорости и как изменится положение налета, если усилить ток в проволоке О.)
Лекция 5
В результате многочисленных соударений молекул газа между собой (~10 9 столкновений за 1 секунду) и со стенками сосуда, устанавливается некоторое статистическое распределение молекул по скоростям. При этом все направления векторов скоростей молекул оказываются равновероятными, а модули скоростей и их проекции на координатные оси подчиняются определенным закономерностям.
При столкновениях скорости молекул изменяются случайным образом. Может оказаться, что одна из молекул в ряде столкновений будет получать энергию от других молекул и ее энергия будет значительно больше среднего значения энергии при данной температуре. Скорость такой молекулы будет большая, но, все-таки она будет иметь конечное значение, так как максимально возможная скорость – скорость света - 3·10 8 м/с. Следовательно, скорость молекулы вообще может иметь значения от 0 до некоторой υ max . Можно утверждать, что очень большие скорости по сравнению со средними значениями, встречаются редко, также как и очень малые.
Как показывают теория и опыты распределение молекул по скоростям не случайное, а вполне определенное. Определим сколько молекул, или какая часть молекул обладает скоростями, лежащими в некотором интервале вблизи заданной скорости.
Пусть в данной массе газа содержится N молекул, при этом dN молекул обладают скоростями, заключенными в интервале от υ до υ +dυ . Очевидно, что это число молекул dN пропорционально общему числу молекул N и величине заданного интервала скорости dυ
где a - коэффициент пропорциональности.
Также очевидно, что dN зависит и от величины скорости υ , так как в одинаковых по величине интервалах, но при разных абсолютных значениях скорости число молекул будет различным (пример: сравните число живущих в возрасте 20 – 21 год и 99 – 100 лет). Это значит, что коэффициент a в формуле (1) должен быть функцией скорости.
С учетом этого перепишем (1) в виде
Из (2) получим
Функция f (υ ) называется функцией распределения. Ее физический смысл следует из формулы (3)
Следовательно, f (υ ) равна относительной доле молекул, скорости которых заключены в единичном интервале скоростей вблизи скорости υ . Более точно функция распределения имеет смысл вероятности любой молекуле газа иметь скорость, заключенную в единичном интервале вблизи скорости υ . Поэтому ее называют плотностью вероятности .
Проинтегрировав (2) по всем значениям скоростей от 0 до получим
Из (5) следует, что
Уравнение (6) называется условием нормировки функции. Оно определяет вероятность того, что молекула имеет одно из значений скорости от 0 до . Скорость молекулы имеет какое-нибудь значение: это событие достоверное и его вероятность равна единице.
Функция f (υ ) была найдена Максвеллом в 1859 году. Она была названа распределением Максвелла :
где A – коэффициент, который не зависит от скорости, m – масса молекулы, T – температура газа. Используя условие нормировки (6) можно определить коэффициент A :
Взяв этот интеграл, получим A :
С учетом коэффициента А функция распределения Максвелла имеет вид:
При возрастании υ множитель в (8) изменяется быстрее, чем растет υ 2 . Поэтому функция распределения (8) начинается в начале координат, достигает максимума при некотором значении скорости, затем уменьшается, асимптотически приближаясь к нулю (рис.1).
Рис.1. Максвелловское распределение молекул
по скоростям. T 2 > T 1
Используя кривую распределения Максвелла можно графически найти относительное число молекул, скорости которых лежат в заданном интервале скоростей от υ до dυ (рис.1, площадь заштрихованной полоски).
Очевидно, что вся площадь, находящаяся под кривой дает общее число молекул N . Из уравнения (2) с учетом (8) найдем число молекул, скорости которых лежат в интервале от υ до dυ
Из (8) также видно, что конкретный вид функции распределения зависит от рода газа (масса молекулы m ) и от температуры и не зависит от давления и объема газа.
Если изолированную систему вывести из состояния равновесия и предоставить самой себе, то через некоторый промежуток времени она вернется в состояние равновесия. Этот промежуток времени называется временем релаксации . Для различных систем он различный. Если газ находится в равновесном состоянии, то распределение молекул по скоростям не изменяется с течением времени. Скорости отдельных молекул беспрерывно изменяются, однако число молекул dN , скорости которых лежат в интервале от υ до dυ все время остается постоянным.
Максвелловское распределение молекул по скоростям всегда устанавливается, когда система приходит в состояние равновесия. Движение молекул газа хаотичное. Точное определение хаотичности тепловых движений следующее: движение молекул полностью хаотично, если скорости молекул распределены по Максвеллу . Отсюда следует, что температура определяется средней кинетической энергией именно хаотичных движений . Как бы ни велика была бы скорость сильного ветра, она не сделает его «горячим». Ветер даже самый сильный, может быть и холодным и теплым, потому что температура газа определяется не направленной скоростью ветра, а скоростью хаотического движения молекул.
Из графика функции распределения (рис.1) видно, что число молекул, скорости которых лежат в одинаковых интервалах dυ , но вблизи различных скоростей υ , больше в том случае если скорость υ приближается к скорости, которая соответствует максимуму функции f (υ ). Эта скорость υ н называется наивероятнейшей (наиболее вероятной).
Продифференцируем (8) и приравняем производную к нулю:
то последнее равенство выполняется когда:
Уравнение (10) выполняется при:
Первые два корня соответствуют минимальным значениям функции. Тогда скорость, которая соответствует максимуму функции распределения, найдем из условия:
Из последнего уравнения:
где R – универсальная газовая постоянная, μ – молярная масса.
С учетом (11) из (8) можно получить максимальное значение функции распределения
Из (11) и (12) следует, что при повышении T или при уменьшении m максимум кривой f (υ ) сдвигается вправо и становится меньше, однако площадь под кривой остается постоянной (рис.1).
Для решения многих задач удобно пользоваться распределением Максвелла в приведенном виде. Введем относительную скорость:
где υ – данная скорость, υ н – наивероятнейшая скорость. С учетом этого уравнение (9) принимает вид:
(13) – универсальное уравнение. В таком виде функция распределения не зависит ни от рода газа, ни от температуры.
Кривая f (υ ) ассиметрична. Из графика (рис.1) видно, что большая часть молекул имеет скорости большие, чем υ н . Асимметрия кривой означает, что средняя арифметическая скорость молекул не равна υ н . Средняя арифметическая скорость равна сумме скоростей всех молекул, деленная на их число:
Учтем, что согласно (2)
Подставив в (14) значение f (υ ) из (8) получим среднюю арифметическую скорость:
Средний квадрат скорости молекул получим, вычислив отношение суммы квадратов скоростей всех молекул к их числу:
После подстановки f (υ ) из (8) получим:
Из последнего выражения найдем среднюю квадратичную скорость:
Сопоставляя (11), (15) и (16) можно сделать вывод, что, и одинаково зависят от температуры и отличаются только численными значениями: (рис.2).
Рис.2. Распределение Максвелла по абсолютным значениям скоростей
Распределение Максвелла справедливо для газов находящихся в состоянии равновесия, рассматриваемое число молекул должно быть достаточно большим. Для малого числа молекул могут наблюдаться значительные отклонения от распределения Максвелла (флуктуации).
Первое опытное определение скоростей молекул провел Штерн в 1920 году. Прибор Штерна состоял из двух цилиндров разных радиусов, закрепленных на одной оси. Воздух из цилиндров был откачен до глубокого вакуума. Вдоль оси натягивалась платиновая нить, покрытая тонким слоем серебра. При пропускании по нити электрического тока она нагревалась до высокой температуры (~1200 о С), что приводило к испарению атомов серебра.
В стенке внутреннего цилиндра была сделана узкая продольная щель, через которую проходили движущиеся атомы серебра. Осаждаясь на внутренней поверхности внешнего цилиндра, они образовывали хорошо наблюдаемую тонкую полоску прямо напротив прорези.
Цилиндры начинали вращать с постоянной угловой скоростью ω. Теперь атомы, прошедшие сквозь прорезь, оседали уже не прямо напротив щели, а смещались на некоторое расстояние, так как за время их полета внешний цилиндр успевал повернуться на некоторый угол. При вращении цилиндров с постоянной скоростью, положение полоски, образованной атомами на внешнем цилиндре, смещалось на некоторое расстояние l .
В точке 1 оседают частицы, когда установка неподвижна, при вращении установки частицы оседают в точке 2.
Полученные значения скоростей подтвердили теорию Максвелла. Однако о характере распределения молекул по скоростям этот метод давал приблизительные сведения.
Более точно распределение Максвелла было проверено опытами Ламмерта, Истэрмана, Элдриджа и Коста . Эти опыты достаточно точно подтвердили теорию Максвелла.
Прямые измерения скорости атомов ртути в пучке были выполнены в 1929 году Ламмертом . Упрощенная схема этого эксперимента показана на рис. 3.
Рис.3. Схема опыта Ламмерта
1 - быстро вращающиеся диски, 2 - узкие щели, 3 - печь, 4 - коллиматор, 5 - траектория молекул, 6 – детектор
Два диска 1, насаженные на общую ось, имели радиальные прорези 2, сдвинутые друг относительно друга на угол φ . Напротив щелей находилась печь 3, в которой нагревался до высокой температуры легкоплавкий металл. Разогретые атомы металла, в данном случае ртути, вылетали из печи и с помощью коллиматора 4 направлялись в необходимом направлении. Наличие двух щелей в коллиматоре обеспечивало движение частиц между дисками по прямолинейной траектории 5. Далее атомы, прошедшие прорези в дисках, регистрировались с помощью детектора 6. Вся описанная установка помещалась в глубокий вакуум.
При вращении дисков с постоянной угловой скоростью ω, через их прорези беспрепятственно проходили только атомы, имевшие некоторую скорость υ . Для атомов, проходящих обе щели должно выполняться равенство:
где Δt 1 - время пролета молекул между дисками, Δt 2 - время поворота дисков на угол φ . Тогда:
Изменяя угловую скорость вращения дисков можно было выделять из пучка молекулы, имеющие определенную скорость υ , и по регистрируемой детектором интенсивности судить об относительном содержании их в пучке.
Таким способом удалось экспериментально проверить Максвелловский закон распределения молекул по скоростям.
Предположение, что молекулы тела могут иметь любую скорость, сначала теоретически доказал в 1856 году английский физик Дж. Максвелл . Он считал, что ско-рость молекул в данный момент времени является случайной, и поэтому их распре-деление по скоростям носит статистический характер (распределение Максвелла ).
Установленный им характер распределе-ния молекул по скоростям графически пред-ставлен кривой, изображенной на рис. 1.17. Наличие у нее максимума (бугра) свиде-тельствует о том, что скорости большинства молекул приходятся на определенный ин-тервал. Она несимметричная, поскольку мо-лекул с большими скоростями меньше, чем с небольшими.
Быстрые молекулы определяют течение многих физических процессов при обычных условиях. Например, благодаря им происхо-дит испарение жидкостей, ведь при ком-натной температуре большинству молекул недостаточно энергии, чтобы разорвать связь с другими молекулами (она намного выше (3 / 2) . kT), а у молекул с высокими скоростями она достаточная.
 |
| Рис. 1.18. Опыт О. Штерна |
Распределение молекул по скоростям Мак-свелла на протяжении продолжительного вре-мени оставалось экспериментально непод-твержденным, и лишь в 1920 году немецкий ученый О. Штерн сумел экспериментально измерить скорости теплового движения мо-лекул .
На горизонтальном столе, который мог поворачиваться вокруг вертикальной оси (рис. 1.18), находились два коаксиальных цилиндра A и B. из которых откачивали воздух до давления порядка 10 -8 Па. Вдоль оси цилиндров находилась платиновая про-волока C, покрытая тонким слоем серебра. При прохождении по проволоке электри-ческого тока она нагревалась, и с ее по-верхности интенсивно испарялось серебро, которое преимущественно оседало на внут-ренней поверхности цилиндра A. Часть мо-лекул серебра проходила сквозь узкую щель в цилиндре A наружу, попадая на поверх-ность цилиндра B. Если цилиндры не вра-щались, молекулы серебра, двигаясь прямо-линейно, оседали напротив щели в окруж-ности точки D. Когда же систему приво-дили в движение с угловой скоростью около 2500—2700 об/с, изображение щели смеща-лось в точку E, а ее края «размывались», образовывая бугор с пологими склонами.
В науке опыт Штерна оконча-тельно подтвердил справедли-вость молекулярно-кинетической теории.
Приняв во внимание, что смещение l = v . t = ω R A t , а время полета молекул t = (R B — R A) / v , получим:
l = ω(R B — R A) R A / v .
Как видно из формулы, смешение мо-лекулы от точки D зависит от скорости ее движения. Вычисления скорости молекул серебра по данным опыта Штерна при тем-пературе спирали около 1200 °C давали зна-чения в пределах от 560 до 640 м/c, что хорошо сочеталось с теоретически опре-деленной средней скоростью молекул 584 м/с.
Средняя скорость теплового движения мо-лекул газа может быть найдена с помощью уравнения p = nm 0 v̅ 2 х :
E̅ = (3 / 2) . kT = m 0 v̅ 2 / 2.
Отсюда средний квадрат скорости посту-пательного движения молекулы равен:
v̅ 2 = 3 kT / m 0 , или v̅ = √(v̅ 2) = √(3 kT / m 0). Материал с сайта
Корень квадратный из средне-го квадрата скорости молеку-лы называется средней квад-ратичной скоростью .
Учитывая, что k = R / N A и m 0 = M / N A , из формулы v̅ = √(3 kT / m 0) получим:
v̅ = √ (3RT / M).
По этой формуле можно вычислить сред-нюю квадратичную скорость молекул для лю-бого газа. Например, при 20°C (T = 293K) для кислорода она равна 478 м/с, для воздуха — 502 м/с, для водорода — 1911 м/с. Даже при таких значительных скоростях (при-близительно равняется скорости распростра-нения звука в данном газе) передвижение молекул газа не такое уж стремительное, поскольку между ними происходят много-численные столкновения. Поэтому траекто-рия движения молекулы напоминает траек-торию движения броуновской частицы.
Средняя квадратичная скорость молекулы не существенно от-личается от средней скорости ее теплового движения — она приблизительно в 1,2 раза боль-ше.
На этой странице материал по темам:
Молекулярная физика доклад
10 класс физика скорость движения молекул опыт штерна
Опыт штерна суть кратко
Реферат про опыт штерна
Доклад по физике опыт штерна
Вопросы по этому материалу:
В середине XIX века была сформулирована молекулярно-кинетическая теория, но тогда не было никаких доказательств существования самих молекул. Вся теория базировалась на предположении о движении молекул, но как измерить скорость их движения, если они невидимы?
Теоретики первыми нашли выход. Из уравнения молекулярно-кинетической теории газов известно, что
Получена формула для расчета среднеквадратичной скорости, но масса молекулы неизвестна. Запишем по-другому значение υ кв:
 |
(2.1.2) |
А мы знаем, что , тогда
| (2.1.3) |
Где Р – давление; ρ - плотность. Это уже измеряемые величины.
Например, при плотности азота, равной 1,25 кг/м, 3 , при t = 0 °С и P
= 1 атм, скорости молекул азота . Для водорода: ![]() .
.
При этом интересно отметить, что скорость звука в газе близка к скорости молекул в этом газе , где γ – коэффициент Пуассона. Это объясняется тем, что звуковые волны переносятся молекулами газа.
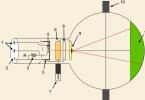
Проверка того факта, что атомы и молекулы идеальных газов в термически равновесном пучке имеют различные скорости, была осуществлена немецким физиком Отто Штерном (1888-1969) в 1920 г. Схема его установки приведена на рис. 2.1.

Рис. 2.1
Платиновая нить А
, покрытая снаружи серебром, располагается вдоль оси коаксиальных цилиндров S 1 , S 3
,. Внутри цилиндров поддерживается низкое давление порядка Па. При пропускании тока через платиновую нить она разогревается до температуры выше точки плавления серебра (961,9 °С). Серебро испаряется, и его атомы через узкие щели в цилиндре S 1
, и диафрагме S 2
, летят к охлаждаемой поверхности цилиндра S 1
, на которой они осаждаются. Если цилиндры S 1 , S 3
и диафрагма не вращаются, то пучок осаждается в виде узкой полоски D
на поверхности цилиндра S 3
. Если же вся система приводится во вращение с угловой скоростью ![]() то изображение щели смещается в точку D´
и становится расплывчатым.
то изображение щели смещается в точку D´
и становится расплывчатым.
Пусть l – расстояние между D и D´ , измеренное вдоль поверхности цилиндра S 3 , оно равно где – линейная скорость точек поверхности цилиндра S 3 , радиусом R ; - время прохождения атомами серебра расстояния . Таким образом, имеем откуда – можно определить величину скорости теплового движения атомов серебра. Температура нити в опытах Штерна равнялась 1200 °С, что соответствует среднеквадратичной скорости . В эксперименте для этой величины получилось значение от 560 до 640 м/с. Кроме того, изображение щели D´ всегда оказывалось размытым, что указывало на то, что атомы Ag движутся с различными скоростями.
Таким образом, в этом опыте были не только измерены скорости газовых молекул, но и показано, что они имеют большой разброс по скоростям. Причина – в хаотичности теплового движения молекул. Ещё в XIX веке Дж. Максвелл утверждал, что молекулы, беспорядочно сталкиваясь друг с другом, как-то «распределяются» по скоростям, причём вполне определённым образом.